重磅!总生存期提高61.3%!全球首款乳腺癌免疫疗法获批上市!
癌症免疫疗法的脚步根本停不下来。
美国时间3月8日,FDA给三阴性乳腺癌患者送上最好的节日礼物!
全球首款用于治疗乳腺癌的免疫检查点抑制剂-atezolizumab(阿特珠单抗)获批上市!
FDA加速批准atezolizumab(TECENTRIQ®,Genentech Inc.)与紫杉醇蛋白结合,用于成人患者无法切除的局部晚期或转移性三阴性乳腺癌(TNBC)。这一疗法要求患者的肿瘤PD-L1表达是阳性(PD-L1(肿瘤浸润性免疫细胞)表达≥1%),而PD-L1的表达情况需由FDA批准的伴随诊断设备VENTANA PD-L1 (SP142)进行检测。
关于三阴性乳腺癌
据统计,大约15%的乳腺癌是三阴性的(雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)均为阴性)。为什么大家都怕三阴乳腺癌:
发病年龄早,多为40岁以下的女性
细胞分化差,易转移
易复发,多发生在1~3年
无病生存期比较短,整体生存率较差
治疗手段有限,仅化疗
肿瘤侵袭性强,容易耐药
总生存期提高61.3%,全球首款乳腺癌免疫疗法!
此次批准是基于 IMpassion130试验的研究结果。这是第一项在三阴性乳腺癌中得到阳性结果的免疫疗法临床试验。
试验设计:
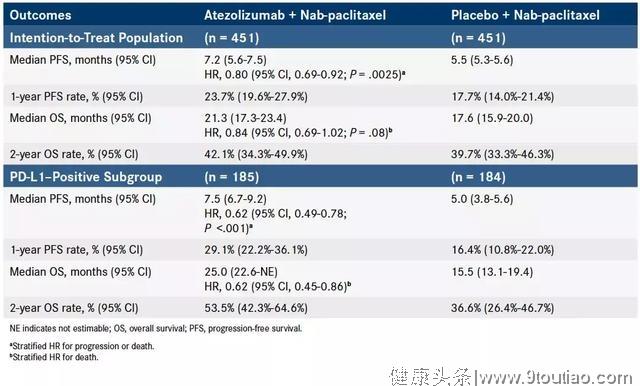
该研究是多中心随机双盲Ⅲ期临床研究,研究入组902例患者,主要研究终点无进展生存和总生存,在所有意向治疗人群和PD-L1阳性人群中进行分析。
转移性三阴乳腺癌TNBC(N = 902)患者随机1:1分配到接受抗PD-L1抗体阿特珠单抗atezolizumab加白蛋白-紫杉醇(n = 451)或白蛋白-紫杉醇加安慰剂(n = 451),其中40%患者为PD-L1阳性(肿瘤或免疫细胞表达≥1%) 。
该研究有两个主要终点:意向治疗(ITT)人群和PD-L1阳性亚组的总生存期OS和无进展生存期PFS。
实验结果:
在中位随访12.9个月时,两个亚组中的atezolizumab治疗患者具有统计学显着的PFS益处。
- 在意向治疗人群中,atezolizumab组的中位PFS为7.2个月,而安慰剂组为5.5个月。
- 在PD-L1阳性人群中,atezolizumab组的中位PFS为7.4个月,安慰剂组为4.8个月,同时减少40%疾病进展或死亡的风险!
另外,Atezolizumab组中有53%的患者肿瘤缩小,也就是客观缓解率53%。而安慰剂组的客观缓解率只有33%。
小结:
意向治疗人群的中位总生存期没有达到统计学意义(atezolizumab组的中位OS为21.3个月,安慰剂组为17.6个月。)然而,PD-L1阳性亚组的总生存期显著改善,延长9.5个月!(atezolizumab治疗组25.0个月,安慰剂组15.5个月),提升了近61.3%,这是前所未有的!
确定最佳获益人群:
使用PD-L1作为生物标志物存在挑战,因此难以确定适合这种治疗的候选者。原因是是PD-L1阳性和阴性可以由多种生物学机制产生,每种生物学机制都可以影响抗PD-L1疗法的功效。
一项亚组分析发现只有9%的肿瘤细胞表达PD-L1,而免疫细胞有40%。既往,肿瘤细胞的PD-L1表达已被用于判定免疫疗法效果,但在TNBC患者中,发现免疫细胞的PD-L1是对atezolizumab加nab-紫杉醇的反应的最强有力的预测生物标志物。
研究人员将进一步研究免疫细胞PD-L1作为TNBC的预测生物标志物的可行性。
关于阿特珠单抗
PD-L1抑制剂阿特珠单抗atezolizumab目前已经在美国获批,价格昂贵,香港价格74000港币,国内还未上市;白蛋白紫杉醇目前在国内已获批用于乳腺癌,虽在不少地方已进医保,但价格仍比普通紫杉醇昂贵。因此目前临床试验还在进行atezolizumab与其它化疗药物的组合探索,如吉西他滨/紫杉醇/卡铂等。通用名:Atezolizumab(阿特利珠单抗,阿替利组单抗)
商品名:TECENTRIQ
生产厂家:基因泰克
美国上市日期:2016年5月18日
适应症:TECENTRIQ是一种程序性死亡-配体1(PD-L1)阻断抗体,用于治疗以下患者:
(1)局部晚期或转移性尿路上皮癌具有以下特征的患者:
①不适合含顺铂的化疗,由FDA批准的检测来确定肿瘤表达PD-L1(PD-L1染色的肿瘤浸润性免疫细胞覆盖肿瘤面积的5%以上)。
或者
②无论PD-L1的状态如何,不适合任何含铂类的化疗。
或者
③在铂类化疗期间或化疗后疾病出现进展,或在新辅助或辅助化疗后12个月内疾病出现进展。
(2)与贝伐珠单抗、紫杉醇和卡铂联用,用于无EGFR或ALK基因突变的转移性非小细胞肺癌患者的一线治疗。
(3)在铂类化疗期间或化疗后出现进展的转移性非小细胞肺癌。肿瘤有EGFR或ALK基因组突变的患者应在FDA批准的治疗过程中出现疾病进展后再接受TECENTRIQ治疗。
(4)与紫杉醇蛋白结合,用于成人患者无法切除的局部晚期或转移性三阴性乳腺癌(TNBC)。这一疗法要求患者的肿瘤PD-L1表达是阳性(PD-L1(肿瘤浸润性免疫细胞)表达≥1%)
用法用量:
(1)转移性尿路上皮癌或曾经治疗过的非小细胞肺癌:
静脉输注1200毫克,每3周1次,每次输注时间超过60分钟。
(2)一线治疗非鳞癌非小细胞肺癌:
静脉输注1200毫克,输注时间超过60分钟,之后在同一天给予贝伐珠单抗、紫杉醇和卡铂,每3周一次最多给予4-6个周期。化疗完成后,给予TECENTRIQ 1200mg 静脉输注,再给予贝伐珠单抗,每3周一次。
若患者能耐受第一剂TECENTRIQ,则后续输注时间可能超过30min即可。
(3)对于TNBC患者:
其肿瘤表达PD-L1的推荐的剂量是840mg,在60分钟内静脉输注,然后给与白蛋白紫杉醇100mg / m 2。对于28天的周期,在第1天和第15天施用atezolizumab,并且在第1,8和15天施用紫杉醇蛋白结合直至疾病进展或不可接受的毒性。
剂型规格:
注射剂:1200mg/20mL(60mg/mL)溶液,单剂量小瓶。
禁忌症:无。
注意事项:
(1)免疫介导性肺炎:根据肺炎严重程度,暂停或永久停用。
(2)免疫介导性肝炎:监测肝功能的变化。根据转氨酶或总胆红素升高的严重程度,暂停或永久停用。
(3)免疫介导性结肠炎:根据结肠炎严重程度,暂停或永久停用。
(4)免疫介导性内分泌疾病:
① 垂体炎:根据垂体炎严重程度,暂停或永久停用。
② 甲状腺疾病:监测甲状腺功能的变化。根据甲状腺功能亢进的严重程度暂停给药。
③ 肾上腺功能不全:根据肾上腺功能不全的严重程度暂停给药。
④ 1型糖尿病:根据高血糖的严重程度暂停给药。
(5)感染:严重或危及生命的感染暂停给药。
(6)输液反应:根据输液反应的严重程度,暂停、缓慢输注或永久停用。
(7)胎儿毒性: 可导致胎儿损伤。建议育龄期女性注意对胎儿的潜在危险并使用有效的避孕方法。
不良反应:
(1)TECENTRIQ单药使用最常见的不良反应(≥20%)为疲劳、恶心、便秘、咳嗽、呼吸困难和食欲下降。
(2)与贝伐珠单抗、紫杉醇和卡铂联用,最常见的不良反应(≥20%)为疲劳/乏力、脱发、恶心、腹泻、便秘、食欲下降、关节疼痛、高血压和周围神经病变。
贮存:
2-8℃,避光。
写给三阴性乳腺癌患者的话
作为一种全新的治疗模式,精准医学指导下的乳腺癌精准治疗已成为大势所趋。精准治疗使不同人群治疗日益精准,通过基因分子分型进行“分类而治”,可有效改善三阴乳腺癌患者的预后。全球肿瘤医生网为患者提供全球最新抗癌技术及权威癌症专家,如需了解详情可致电医学部400-666-7998。