最强联盟不过如此!K药联合乐伐替尼公然向六种癌症宣战!
2018年,FDA获批新药的数量和质量都创出了历史新高,中国新药获批上市的好消息也频频传出,其中派姆单抗(Keytruda,简称K药)和lenvatinib(乐伐替尼)更是上市新药中的爆款!如今,两款新药的研发公司又宣称即将公布K药和乐伐替尼强强联手后的最新数据!此条消息一出,吊足了大家的胃口,令大家满心期待!
就在今天,卫材公司宣布在今年第33届Sitc年度会议上将要公布乐伐替尼联合派姆单抗的Ib/II期临床研究(Study 111/KEYNOTE-146)的非小细胞肺癌、黑色素瘤和尿路上皮癌的最新数据。
乐伐替尼与派姆单抗
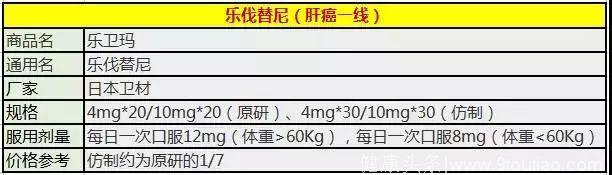
乐伐替尼是卫材开发的一种口服激酶抑制剂,具有新的结合模式,可选择性抑制血管内皮生长因子(VEGF)受体(VEGFR1,VEGFR2和VEGFR3)和成纤维细胞生长因子(FGF)受体的多重活性。 (FGFR1,FGFR2,FGFR3和FGFR4)以及其他与通路相关的RTK(包括血小板衍生生长因子(PDGF)受体PDGFRα; KIT;和RET)参与肿瘤血管生成,肿瘤进展和肿瘤免疫修饰。目前仑伐替尼已批准用于治疗难治性甲状腺癌,其与依维莫司联合批准于肾细胞癌的二线治疗药物。此外,乐伐替尼还被批准用于治疗肝细胞癌患者。
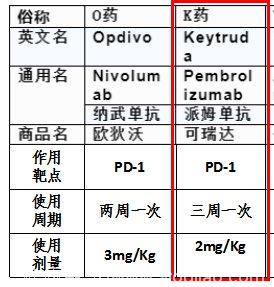
默克公司的PD-1抑制剂pembrolizumab
(产品名称:KEYTRUDA,简称K药)
Ib/II期期临床研究回顾
2018年3月,Eisai与Merck进行了战略合作,共同开发仑伐替尼作为单药治疗和与K药的联合使用。除了正在进行的联合临床研究外,两家公司还将共同开展评估LENVIMA和KEYTRUDA组合的新临床研究,以支持六种癌症(膀胱癌,子宫内膜癌,头颈癌,肝细胞癌,黑色素瘤和非小细胞肺癌)的11种潜在适应症,以及针对几种癌症类型的篮子试验。

基于这项多中心、开放标签Ib/II期RCC队列研究-Study 111,接受K药和乐伐替尼联合治疗的患者的目标反应率(ORR)为63.3%。这两种药物的制造商Merck (MSD) 和 Eisai宣称,这一突破性结果将有助于加快这一组合临床应用进展。FDA已批准PD-1抑制剂pembrolizumab(Keytruda)和VEGF / FGF抑制剂lenvatinib(Lenvima)的组合用于治疗晚期和/或转移性肾细胞癌(RCC)患者的治疗。
Study 111共招募了13名转移实体瘤患者,8名ECOG 评分≤1,先前治疗后又进展的患者。乐伐替尼起始剂量24mg每天一次,由于毒性减少者20mg每天一次,这一剂量一直延续用于II期试验入组的22名晚期肾癌患者,先前已经接受过2线治疗。II期患者由于毒性将乐伐替尼剂量递减至14mg、10mg、8mg与4mg,直到耐受,但是剂量不允许再上调。派姆单抗两个阶段都是每三周200mg,不耐受毒性也进行剂量干预。前24周每6周评估一次,然后每9周。26个病人中12个PD-L1阳性(40%)。持续治疗时间为9.5个月,乐伐替尼的平均剂量为15.8mg/天,派姆单抗是191.9mg/周期。24周时客观反映率(ORR)达83%,在PD-L1阳性和PD-L1阴性患者中,都可以看到反应时间延长,在治疗组中,PD-L1阳性患者12月的治疗中病情稳定。30名患者中有28人肿瘤变小,并有持续变小趋势。
由于不良反应18人调整了剂量,5人停药至少一种。最常见的不良反应是腹泻(83%)、疲劳(70%)、甲状腺机能减退(67%)、口腔炎(60%)、高血压(57%)和恶心(57%)。没有发现新的安全信号。2-5级不良反应都与疾病进展有关,而与药物无关。
突破性资格旨在授予在治疗一种严重或危及生命的疾病过程中证明与现有疗法相比有明显改善的药物。可见,乐伐替尼与K药的联合疗法获得这一殊荣当之无愧。两家公司表示,它们将开发该合并用药用于另外 6 种类型癌症的11 种不同的适应证。


仑伐替尼和K药的组合目前尚在临床研究阶段,两款药物在Sitc年会上有哪些新的好消息公布呢?让我们拭目以待吧!
http://www.globecancer.com/azzx/show.php?itemid=7229