Nature:血液中的“哨兵”,可诊断早期胰腺癌

胰腺癌是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤,其发病率和死亡率近年来明显上升。更糟糕的是,胰腺癌早期并没有明显的征兆,病程短且发展快。依据美国癌症协会的数据,80%的胰腺癌患者确诊后生存时间不超过1年。
想要挽救更多的胰腺癌患者,除了医疗手段改进之外,还需要从早期诊断入手。如何做到及早诊断呢?近期,来自于美国生物设计Virginia G. Piper 中心个性化诊断的研究员Tony Hu带领团队开发了一个巧妙的方法,能够实现胰腺癌早期诊断。他们的技术关键是“灵敏检测胞外囊泡(EVs)”。
胞外囊泡是指从细胞膜脱落或者由细胞分泌的囊泡状小体。Tony Hu教授团队检测的囊泡,是由肿瘤细胞分泌的。这类囊泡表面表达有一种特殊的蛋白质——EphA2,是胰腺癌的特殊标记物。他们设计出一种与EphA2蛋白结合的特定纳米探针,从而精准鉴定出血液等体液中存在的由胰腺癌细胞分泌的囊泡。相关研究成果在线发表在《Nature Biomedical Engineering》期刊。
什么是胞外囊泡?
胞外囊泡是细胞释放的微型版本,具有双层膜结构,有多种类型,例如微囊泡和外泌体(exosome)。
过去,科学家们认为胞外囊泡仅仅只是细胞代谢活动中被遗弃的碎片。现在,越来越多的研究证实,囊泡促成细胞间微妙而复杂的交流网络,且在物种间具有高度保守性。此外,胞外囊泡在先天性和适应性免疫反应中也发挥着关键作用。更重要的是,因为携带有原细胞的多种蛋白、脂质、DNA等信息,可以作为多种疾病的诊断标志物,所以一直是疾病诊断领域的研究热点之一。
Tony Hu教授团队靶向的囊泡就是外泌体,直径在50-150nm之间。外泌体主要来源于细胞中内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质。
胞外囊泡是癌细胞开疆拓土的“探路者”
胞外囊泡参与癌症的发生、发展。当囊泡由癌变细胞分泌而出,它们会迁移至其他组织,并修改微环境,从而创造一个有利于肿瘤迁移的生态。这种功能类似于一个新大陆的“开拓者”,促进癌细胞的增殖和扩散。也有证据表明,肿瘤细胞分泌的外泌体通过清除或者中和抗癌药物,助长肿瘤细胞的耐药性。
伴随着疾病的恶化,肿瘤细胞分泌的囊泡也会增加,所以它们可以作为评估癌症发展、治疗效果的有效标志物。胰腺癌常存在耐药性,提高疾病监测准确度是实现个性化治疗的必要步骤。
此外,对胞外囊泡加深研究,有助于了解其促进癌症发展、转移的关键机制,从而有望为癌症治疗提供有效的靶点。
如何诊断早期胰腺癌?
目前,胰腺癌的治疗手段依然以外科手术为主,但是因为胰腺癌早期诊断困难,手术切除率低,所以常常无法根治。Hu教授表示:“胰腺癌的诊断离不开血液标志物。它不像乳腺癌,患者会依据身体疼痛、异常增生等症状尽早得到诊疗。胰腺癌早期症状不明显,所以很难在癌症早期得到确诊。”
胞外囊泡能够从多种体液中分离出来,例如唾液、尿液、血液等等。但是,常规分析胞外囊泡的方法在分离、纯化过程需消耗过多时间,并不适用于临床诊断。此外,迄今为止,尚没有能够精准区别肿瘤细胞分泌囊泡的生物标志物。所以,真正的难题是:如何从多种囊泡中鉴定出与肿瘤相关的囊泡?
为了解决这些问题,研究团队开发了一个基于纳米探针的快速检测技术:
首先,采集少量血液样本(约1微升),稀释并加至传感器芯片,芯片表面覆盖有与囊泡膜蛋白结合的抗体。随后,与抗体结合的胞外囊泡会与抗体包被的纳米探针混合,这两种纳米探针会再一次与另外两种囊泡膜蛋白结合,其中一种就是胰腺癌特有的EphA2蛋白。只有胰腺癌细胞分泌的胞外囊泡会同时与两种纳米探针结合。最后,当两种探针在囊泡表面亲密接触后,会引发一种耦合效应,从而发射出黄色的光信号。
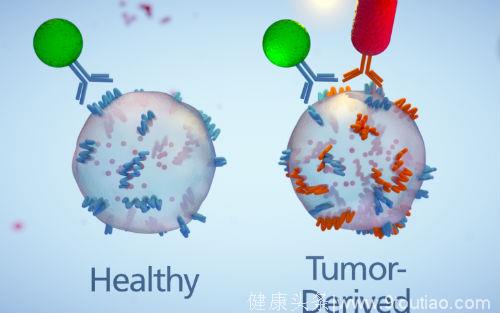
胰腺癌早期诊断技术原理图示:。他们设计了两种折射不同波长光的纳米探针(绿色的球、红色的杆),其中一个探针能够与胰腺癌相关囊泡的表面蛋白ephA2结合,而另一个探针负责识别囊泡表面常见的蛋白质。仅仅只有胰腺癌细胞分泌的囊泡才会同时表达两种蛋白质,从而会吸引两种探针,最终释放出黄色的信号。
研究团队经过一系列试验,确定该技术能够检测早期胰腺癌,且能够从胰腺癌患者、胰腺炎患者以及健康人血液中精准筛选到癌症标志物。虽然目前的研究依然需要光学显微镜检测样本,但是研究人员计划开发出一款完全自动化的系统,能够以低成本、高通量的优势完成临床诊断。
这一最新研究展现出广泛的应用前景,它将胞外囊泡作为诊断疾病的切入点,通过设计不同的纳米探针就可以实现不同疾病的检测。
参考资料:
Sentinels in the blood: A new diagnostic for pancreatic cancer