“O药”开售 两大新药PK背后双雄争霸
8月28日,国内首个获批,也是目前唯一获批用于肺癌治疗的百时美施贵宝重磅PD-1抑制剂Opdivo(下称O药)正式开始在国内销售。而在一个月前,默沙东公司的“Keytruda(下称K药)”也已获国内药监部门批准。
全球最知名的两个免疫治疗新药,终于全面登陆中国。两大新药正面PK的背后也是百时美施贵宝和默沙东的双雄争霸。而在此激烈竞争下,中国癌症免疫新药又发展几何呢?
“OK药”陆续在国内获批上市
O药和K药都是PD-1类的明星药物,且都在2014年获FDA批准上市。
2018年7月26日默沙东公司的PD-1抑制剂药物K药成功获得中国国家药品监督管理局审批,用于经一线治疗失败的不可切除或转移性黑色素瘤的治疗,也是目前国内唯一获批用于黑色素瘤的PD-1抑制剂。因其从提交申请到上市仅不到6个月的时间,这也创下中国进口抗肿瘤生物制剂最快的审批记录。
百时美施贵宝公司所研发的O药已在2017年11月进行上市申请,在历时7个月后,于2018年6月15日获得中国国家药品监督管理局的正式批准,正式成为国内上市的首个针对PD-1的免疫治疗药物。
“此次欧狄沃在中国的获批得益于中国政府在加快创新药物审评审批方面的突破性进展,以及肺癌领域专家为改善患者治疗状况而做出的不懈努力。”百时美施贵宝中国大陆及香港地区总裁赵萍表示,百时美施贵宝将继续探索免疫肿瘤治疗在不同瘤种中的应用,加速将创新药物带入中国,以满足患者迫切的未被满足的治疗需求。

O药和K药的名字都来源于他们的商品名(英文)的首字母,他们的作用机理也非常的相似,都属于免疫治疗PD-1抑制剂。免疫治疗是指通过调节人体自身的免疫细胞来治疗肿瘤的方法。
PD-1蛋白是阻碍免疫细胞活化的重要蛋白,癌细胞可以利用这个机制,“蒙蔽”免疫细胞,以此来避免被免疫细胞吞噬。O药和K药等PD-1抑制剂,可以阻断免疫细胞表面PD-1受体和其配体的结合,从而激活免疫细胞发挥正常的作用,以达到控制癌细胞的效果。
据了解,PD1/PD-L1药物如果起效,将会有明显的拖尾效应(相比化疗和靶向治疗更长的有效期),对很多晚期肿瘤或后线治疗已经无其他选择的患者来说无疑成为救命稻草。
“OK药”理论上应属可相互替代产品
随着使用PD-1的患者越来越多,O药和K药成为患者们最为青睐的两种免疫治疗明星药物。但是对于该选择哪个?很多患者却感到迷茫。基于目前已发布的临床信息,健康界做了以下不完全整理,仅供参考。
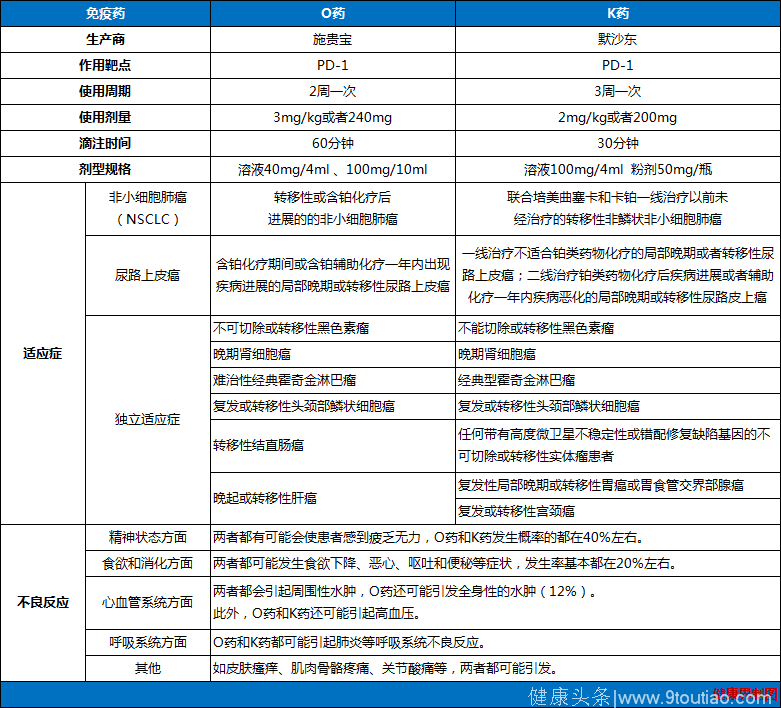
事实上,O药和K药自2014年上市以来在适应证、有效率、不良反应等方面的表现都极为相似,但介于目前并没有临床试验直接对比这两种药物的效果,健康界从两者药理方面做出以下整理,仅供参考。
首先,从结合能力来看,O药略胜一筹,比K药结合能力强近十倍(Kd:3.06pM vs.29pM)。尽管如此,K药结合PD-1的能力比与PD-L1结合PD-1的能力强了两万六千多倍。(提醒:上述数据为体外数据,不能理解为体内数据。)
其次,在药代动力学方面,两种药物的药物代谢动力学表现也极为相似。目前O药的剂量调整申请(每4周一次,每次480mg,原来是3mg/kg/2周)是以半衰期26.7天的代谢数据作为依据的,而K药的半衰期为26天,剂量用法为2mg/kg/3周。
最后,在临床效果上有研究者统计了O药和K药治疗黑色素瘤、非小细胞肺癌、泌尿生殖系统肿瘤临床实验的效果,两者客观缓解率相似(Carbognin etal.,2015)。另一项对1887例化疗后使用O药和K药的非小细胞肺癌患者的统计研究表明两种药物在客观缓解率、总生存期、无进展生存期等方面均无显著性差异,严重不良反应类型和不良反应比例也相似,使用O药的患者>3级不良反应比例要稍少于K药。(提醒:PD-L1表达阳性的患者,客观缓解率要高于阴性患者,在阳性患者中似乎K药强于O药。)
综上所述,O药和K药在绝大多数病人中,就抗体性质而言并没有本质的区别,在PD-1分子结合能力、药物代谢动力学表现、价格等方面也无明显差别,理论上它们属于可相互替代产品。
其临床试验结果不同、已获批的临床适应证不同主要原因在于,临床试验设计方案、纳入患者的筛选条件以及所配套使用的PD-L1检测试剂盒等方面差异所致。因此,对于患者来说最重要的是确定是否属于免疫检查点抑制剂适用群体,至于具体选择哪种药物还需由免疫治疗经验丰富的医生来帮助判断。
“OK药”竞争激烈 国内药企奋起直追
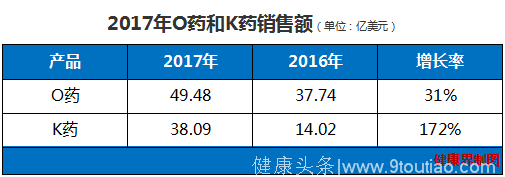
2017年全球PD-1/PD-L1药物市场规模已扩张到约100亿美元,O药虽然仍是目前市场份额最大的一个,但增长势头已经被K药完成压制,领先优势也是显著缩小。如果O药没有新的进展,将可能在2019年被K药反超。
根据业绩报告,2017年O药收入达到49.4亿美元,同比增长31%,远远领先于默沙东公司的K药。值得注意的是,虽然K药销售额比O药稍低,但其增长率达到172%。
从全球来看,BMS、默沙东、罗氏以及阿斯利康为第一梯队;从国内来看,同样是四雄争先,分别是恒瑞医药、信达生物、君实生物及百济神州。
由于不同的抗PD-1/PD-L1单抗品种所申报的适应症不同,每个疾病又有自己的临床特点,因此需要精确审评。2018年2月,国家食品药品监督管理局药品审评中心(下称CDE)官网发布《抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求》,提出针对抗PD-1/PD-L1单抗品种面对的研发和申报问题给予明确的政策指引和“Pre-NDA会议”“优先审评”“审评提速”等配套支持。
复杂机制的复杂药物,关键在于如何把握风险获益的尺度,这也是监管需要面对的新问题。作为近年来肿瘤治疗领域的重大突破之一,PD-1/PD-L1单抗在实体瘤治疗中具有重要的投资价值,行业关注度极高,国内在研厂家众多,竞争空前激烈。
2018年4月,CDE发布《拟纳入优先审评程序药品注册申请的公示(第二十八批)》,备受关注的卡瑞利珠单抗(恒瑞)、特瑞普利单抗(君实)、信迪利单抗(信达)三大国产抗PD-1抗体药物被列入优先审评名单,这是国内该领域第一梯队重新规范申报资料后再次踏入上市竞速之路。
除上述3家企业之外,截至目前,百济神州、基石药业、康宁杰瑞、嘉和生物、誉衡药业、复宏汉霖、丽珠、科伦、百奥泰等在内的多家医药企业,已有超过20个国产PD-1/PD-L1单抗向监管部门提交了临床或注册申请,分别处于不同的开发阶段。
对于抗PD-1/PD-L1抗体为代表的免疫治疗产品,站在临床治疗准绳之上,左偏一步是地狱,右偏一步是天堂。业内普遍认为,抗PD-1/PD-L1单抗在第一个药品还没有得到审批之前,很多适应症都可以做,但一旦有药品获批上市,对之后的申报要求必然有所不同,安全性和疗效性门槛可能将进一步提高。
嘉和生物CEO、“千人计划”专家周新华此前曾表示,药物最基本的属性就是安全,没有安全性,有效性就是无稽之谈。与全球已上市药物相比较,新药物必须拥有更佳的安全性、更具改善性的功效。“创新环境重构创新标准,对标O药和K药,未来监管部门将可能出台针对具体瘤肿终点指标的指导原则,国内产品需要具备良好临床试验质量,数据真实性、完整性和可追溯性,符合成本效益至关重要。”
(本文综编自医药经济报、抗癌卫士等)