抗 GBM 病合并 Castleman 病患者的临床和免疫学特点
抗肾小球基底膜(GBM)病是一种经典的自身免疫性疾病,自身抗体攻击 GBM,导致急进性肾小球肾炎和肺泡出血。抗 GBM 抗体所靶向的原代抗原是Ⅳ型胶原α3 链的非胶原区域 [α3(Ⅳ)NC1],此区域有 2 个主要的构象表位 EA 和 EB,分别有 17~31 个氨基酸和 127~141 个氨基酸。
Castleman 病是一种淋巴细胞增生性疾病,是以淋巴滤泡增生和毛细血管增生伴内皮细胞增生为特点的增生性淋巴结。肾脏受累虽然不典型,但在 2 项大型的回顾性研究中也有报道,在 Castleman 病例中肾脏受累的发生率为 25%~54%。
抗 GBM 病和 Castleman 病并存的病例很少见,之前仅有 1 例报道。Castleman 病与多种自身抗体共存的病例有零星报道。Castleman 肿瘤细胞来源的 B 细胞在针对表皮蛋白质的抗体产生和副肿瘤天疱疮的发病机制中的作用已有报道,但是抗 GBM 抗体是否可能来自 Castleman 肿瘤细胞还不清楚,也不清楚这些抗体的免疫学特性。
因此,在本研究中来自北京大学第一医院的赵明辉教授团队报道了 3 例两种疾病并存的病例的临床和免疫学特征,旨在获得有关这一少见病的发病机制方面进一步的信息。文章发表于最新一期的 AJKD 杂志上。
病例一
男性,38 岁,主诉:「发热伴血尿 20 天」。体检发现颈部和锁骨上窝淋巴结肿大。起病时血清肌酐(Scr)水平为 369umol/L(eGFR 17.1 ml/min/1.73m2),之后迅速升高至 693umol/L(eGFR 8.3 ml/min/1.73m2)伴少尿。循环抗 GBM 抗体检测结果阳性,滴度 >200RU/mL。
2 年前,患者就曾发现颈部、锁骨上窝和腹股沟区淋巴结肿大。基于淋巴结活检的结果,做出了「多中心 Castleman 病,混合亚型」的诊断(图 A)。当时 Scr 水平升高为 152umol/L(eGFR 48 ml/ min/1.73m2),但当时未检测抗 GBM 抗体。接受了 4 个周期的 COP 方案(环磷酰胺 + 长春新碱 + 泼尼松)化疗后,淋巴结就触摸不到了,Scr 水平也降至正常。
最近一次入院,他被诊断为「抗 GBM 病和 Castleman 病复发」,接受了血浆置换(PE)、甲强龙冲击治疗和 1 个周期的 R(利妥昔单抗)-COP 方案化疗。虽然接受了积极的治疗,但他的抗 GBM 抗体滴度仍然很高(114RU/mL),患者很快进展至终末期肾病,需要依赖透析。
发现该患者的血清可以识别在人类 GBM 上发现的所有 5 个α链的Ⅳ型胶原的非胶原(NC1)区域和所有 3 个α3 链的Ⅳ型胶原的 NC1 表位(EA、EB 和非 EA/EB)。所有针对α3(Ⅳ)NC1 的循环 IgG 的 4 种亚型均可被检测到,但以 IgG1 亚型为主。
为了研究抗 GBM 抗体是否是从 Castleman 病相关的肿大的淋巴结中的浆细胞中所分泌出来,我们使用标记的重组α3(Ⅳ)NC1 作为淋巴结活检标本的探针,检测到产生与α3(Ⅳ)NC1 起反应的抗体的散发性分泌 IgG 的浆细胞。每高倍镜下(×400 倍)反应性细胞的平均数量是 13.8±2.9,但是在仅仅只有 Castleman 病而没有抗 GBM 病的患者中未发现反应性细胞。在淋巴结中没有发现分泌 IgG4 的浆细胞,因此在该患者中不支持 IgG4 相关性疾病的可能性。
病例二
男性,56 岁,因「咳嗽发热 20 余天,使用抗生素治疗 1 周后出现茶叶水样泡沫尿」入院。尿蛋白排泄量是 2.4 g/d。血检结果显示:血清白蛋白 2.4 g/dl,Scr229umol/L(eGFR 28 ml/min/1.73m2)。进行了肾活检,结果显示新月体性肾小球肾炎和膜性肾病(图 D-F)。经过甲强龙和环磷酰胺治疗后,Scr 水平升至 400.8umol/L(eGFR 14 ml/min/1.73m2)。抗 GBM 抗体检测结果阳性,滴度为 160RU/mL。此时,患者被转至我院。
2 年前,患者曾有颈部淋巴结肿大,切除后的病理评价是「非特异性增生」。
入院后的体检发现,患者双侧颈部、腋窝和腹股沟区淋巴结肿大,Scr 水平升至 598umol/L(eGFR 7 ml/min/1.73m2)。抗 GBM 抗体滴度为 167 RU/mL。尿蛋白排泄量增加至 5.7 g/d。血清白蛋白水平 26.7 g/L。重新对淋巴结标本进行评价,被诊断为「多中心 Castleman 病,浆细胞亚型」(图 B)。
患者接受了 PE 和甲强龙冲击治疗。虽然抗 GBM 抗体滴度降至 27RU/mL,但 Scr 水平仍维持在 600umol/L(eGFR 9 ml/min/1.73 m2)。接受了 R-CHOP 方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松)化疗。1 个周期化疗后,抗 GBM 抗体滴度就检测不到了。又做了 2 个周期化疗后,Scr 水平从 358umol/L 降至 278umol/L(eGFR22 ml/min/1.73m2),淋巴结也触摸不到了。
该患者的血清与所有 5 个α链的(Ⅳ)NC1 域和α3 链(Ⅳ)NC1 的 EA 和 EB 表位起反应。在血清样本中,所有针对α3(Ⅳ)NC1 的循环 IgG 的 4 种亚型均可被检测到,但以 IgG1 亚型为主。
病例三
男性,32 岁,因「大量血尿一月余」被收入我院。7 个月前患者发现锁骨上区域淋巴结肿大,但未进行治疗。入院的体检发现患者颈部、腋窝和腹股沟区域的淋巴结肿大。检查结果提示他患有肾病综合征,尿蛋白排泄量 4.1 g/d,血清白蛋白 29.7 g/L。Scr 水平为 391umol/L(eGFR 17 ml/min/1.73m2)。抗 GBM 抗体检测结果阳性,滴度 164RU/mL。
肾活检结果显示 IgG 沿着 GBM 呈线性沉积和新月体形成(图 H)。电镜显示 GBM 皱缩,新月体形成,无电子致密物沉积(图 I)。淋巴结活检标本被诊断为「多中心 Castleman 病,浆细胞亚型」(图 C)。
治疗方案包括 PE 和甲强龙冲击治疗联合 COP 化疗。2 周后,抗 GBM 抗体未检测到,Scr 水平降至正常范围。但是,在第 3 个周期化疗后,患者出现带状疱疹,遂停止化疗。抗 GBM 抗体滴度增加至 42IU/mL。带状疱疹恢复后,患者又接受了一个周期的化疗,之后他的抗 GBM 抗体滴度回到正常范围。
该患者的血清仅仅只与α1,α2,α3 的(Ⅳ)NC1 以及与 EA 和 EB 抗原表位起反应。在血清样本中,所有针对α3(Ⅳ)NC1 的循环 IgG 的 4 种亚型均可被检测到,但以 IgG1 亚型为主。

图 A: 患者 1 的淋巴结活检标本显示:复杂的淋巴滤泡,透明的血管位于淋巴窦和淋巴结区域,并有大量的浆细胞浸润,被诊断为混合亚型 Castleman 病。
图 B 和图 C 分别代表患者 2 和患者 3 的淋巴结活检标本,光镜下显示:增生性淋巴滤泡、淋巴窦和淋巴结区域显著的浆细胞浸润,被诊断为浆细胞亚型 Castleman 病。
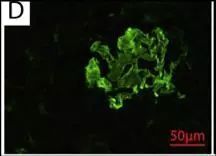

图 D 和图 G 分别代表患者 2 和患者 3 的肾活检标本的免疫荧光结果,显示 IgG 沿着 GBM 线性沉积
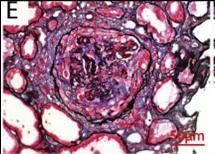
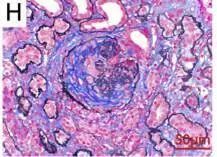
图 E 和图 H 分别代表患者 2 和患者 3 的肾活检标本的光镜结果,显示新月体形成。
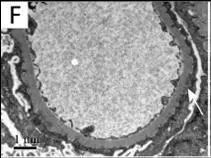
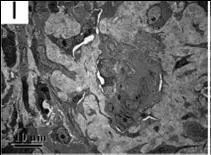
图 F 和图 I 分别代表患者 2 和患者 3 肾活检标本的电镜结果:上皮下电子致密物沉积。
病例讨论
很少有报道抗 GBM 病和 Castleman 病并存的病例。本研究中,我们报道了 3 例这样的患者,使用 Castleman 病有关的肿大的淋巴结活检标本,发现了产生与α3(Ⅳ)NC1 起反应的抗体的浆细胞。这些结果支持 Castleman 病和发生抗 GBM 病之间的因果关系。
Wang 等人在副肿瘤的天疱疮合并 Castleman 病的患者中发现,肿瘤切除后自身抗体水平下降,伴随着皮肤损害缓解。相似的现象在其它病例中也有报道。在本研究中,我们在一位 Castleman 病患者的受累淋巴结中发现了可以产生与α3(Ⅳ)NC1 起反应的抗体的浆细胞。淋巴结的生发中心由 B 细胞产生的大量 IL-6 提供了炎症的环境,可能刺激 B 细胞增生,导致自身抗体产生。病例 3 中的患者在 PE 和化疗后抗 GBM 抗体滴度降低,在由于感染停止化疗后自身抗体便复发,进一步支持了两种疾病的因果关系。
本研究中,我们发现抗 GBM 病和 Castleman 病并存患者的自身抗体的免疫学特点与经典抗 GBM 病患者相似。病例 1 中的患者有严重的肾损伤,有针对所有 5 个α链的(Ⅳ)NC1 区域的抗体和最高浓度的针对抗 EA/EB 的抗体,与之前报道的自身抗体的特点和抗 GBM 病的严重性相一致。在三位患者中,抗α3(Ⅳ)NC1 IgG1 的浓度在 4 种 IgG 亚型中最高,也与之前报道的 IgG 分布一致。
值得注意的是,患者 1 和患者 2 的抗α1(Ⅳ)NC1 抗体的水平与抗α3(Ⅳ)NC1 抗体的水平差不多。Kalluri 等人发现,抗α1(Ⅳ)NC1 的自身抗体与肺腺癌有关。抗α1(Ⅳ)NC1 抗体与肿瘤之间的关系还需要进一步研究。对患者 2 而言,虽然他的抗α1(Ⅳ)NC1 抗体滴度很高,但是却与非 EA/EB α3(Ⅳ)NC1 无反应。很可能被抗α1(Ⅳ)NC1 抗体所识别的抗原表位位于α1(Ⅳ)NC1 的非 EA/EB 区域。
本研究的缺陷在于缺乏患者 2 和 3 的淋巴结组织标本来证实他们的淋巴结中有α3(Ⅳ)NC1 反应性浆细胞。本研究的另一缺陷是我们医院目前不能检测人类疱疹病毒 8(HHV-8)感染。所以我们不能排除这些患者罹患 HHV-8 相关性 Castleman 病的可能性。
总之,在抗 GBM 病和 Castleman 病并存的患者肿大的淋巴结中发现了分泌α3(Ⅳ)NC1 抗体的浆细胞,提示了两种疾病之间的因果关系。这些发现可能为揭示和治疗这种少见情况投下了一线曙光。
参考文献
The Clinical and Immunologic Features of Patients With Combined Anti-GBM Disease and Castleman Disease. AJKD, June 2018 Volume 71, Issue 6, Pages 904–908
编辑 | 徐德宇