一文读懂丨头颈鳞癌免疫治疗进展
导读
早期头颈鳞状细胞癌(HNSCC)治疗通常采用单一手段,如手术或放疗。局部晚期肿瘤治疗方式多样,复发或转移性HNSCC治疗标准是姑息化疗。目前,PD-1抑制剂nivolumab是唯一获批用于铂-难治性复发性或转移性HNSCC的药物。
头颈鳞状细胞癌(HNSCC)是全世界最常见的恶性肿瘤之一,每年新发病例超过55万,死亡病例达38万。大多数局部晚期患者通常接受手术、放疗和全身治疗。然而,近年来,随着手术和放疗技术发展,化疗和EGFR靶向单抗治疗被纳入局部晚期HNSCC治疗,超过一半的患者最终却发生了复发或远处转移。即使应用现代多药物化疗,不可治愈或转移性复发患者的中位生存期仍低于1年。免疫治疗的出现无疑为抗癌治疗提供了强有力的支撑。
头颈癌与免疫系统
众所周知,免疫系统在控制肿瘤生长和进展方面发挥关键作用,肿瘤淋巴细胞浸润与恶性肿瘤预后相关。对于HNSCC,高密度肿瘤浸润淋巴细胞(TIL)与患者预后改善相关。HPV阳性癌中CD8+浸润效应淋巴细胞比例较高。Treg控制自体反应性淋巴细胞,下调肿瘤相关抗原免疫应答。
最新研究发现,相较于对照组,HNSCC患者外周循环中Treg比例增加,这说明HNSCC患者存在全身性免疫抑制环境。DC细胞在启动肿瘤抗原特异性T细胞应答中发挥重要作用,DC细胞亚群具有交叉呈递的独特能力。因此,初始CD4+和CD8+T细胞被激活并分化为肿瘤抗原特异性效应T细胞。肿瘤中高DC细胞浸润与HNSCC患者结局改善显著相关。
CTLA-4和PD-1是T细胞上表达的两种膜蛋白。检查点受体是长期抗原暴露后耗竭的T细胞的特征。抗原暴露时,耗竭的T细胞无法发挥效应应答。PD-1和CTLA-4在HNSCC组织调节性Treg中高表达。PD-1+细胞与HPV阳性肿瘤预后改善相关。PD-1受体有两个配体PD-L1和PD-L2。两种受体在炎性条件下上调,部分由I型和II型干扰素介导。
此外PD-L1和较少PD-L2在许多实体瘤和血液肿瘤上表达。最新研究表明,PD-L1表达与各种恶性肿瘤患者肿瘤分级和预后密切相关。HNSCC中,高PD-L1表达与转移和不良预后相关。
HPV阳性肿瘤的特征为适应性宿主免疫应答直接抵抗病毒抗原,特异性T细胞直接靶向病毒蛋白。HPV阳性肿瘤微环境中含有较高数量的CD8+T细胞,并且CD4/CD8比率降低。HPV阳性肿瘤TIL中PD-L1高表达可能反映了由HPV诱导的强免疫应答。
头颈癌免疫治疗
疫苗
简言之,治疗性肿瘤疫苗的基本原理是:
- 肽或蛋白疫苗是一种或多种特异性肿瘤表达的肽或蛋白与佐剂结合产生的。
- 注射时,DNA/RNA疫苗利用表达肿瘤特异性抗原的外源性操纵核酸。该抗原由抗原呈递细胞加工,诱导抵抗表达相同抗原的肿瘤细胞特异性免疫应答。
- 减毒细菌和病毒载体可以作为传递疫苗中编码基因的质体或蛋白质的载体。
- 关于DC疫苗,DC细胞分离自癌症患者的血液。细胞被重新注射并激活肿瘤特异性T细胞。目前正在进行疫苗与其他免疫治疗结合应用的试验。
肽/蛋白疫苗
随机试验证实,预防性HPV疫苗可以有效预防HPV16和HPV18相关的高级别宫颈癌。目前,全球普遍推荐年轻女性使用二价(HPV16/18)或四价(HPV16/18/6/11)预防性HPV疫苗来预防生殖器疣,宫颈癌,肛门癌,外阴癌和阴道癌前病变。进一步随机试验也表明,男性HPV相关肛门生殖器病变明显减少。
最新的一项横断面研究表明,HPV疫苗显著降低了口腔HPV16/18/6/11感染发病率(0.11 vs 1.61%, p=0.008)。这相当于模型年龄,性别和种族调整后发病率降低了88.2%。男性治疗效果更为显著(发病率0.0 vs 2.13%, p=0.007)。
INK4a在HPV相关癌症中持续而强烈的过表达。最近发表的一项研究探究了INK4a肽疫苗在晚期HPV阳性HNSCC患者中的应用。共计20名患者接受了至少4次注射,14名患者被检测到CD4+T细胞,5名患者被检测到CD8+T细胞,14名患者被检测到抗体。疫苗安全且毒性较低。14名可评估肿瘤反应的患者中,9名患者疾病稳定,总体反应良好。
VICORYX-2试验正在研究疫苗和铂类化疗组合治疗晚期HPV阳性宫颈癌,外阴癌,阴道癌,阴茎癌,肛门癌或头颈癌的疗效。
DNA/RNA疫苗
MEDI0457(曾用名INO-3112)是一种DNA癌症疫苗,其主要成分为两种:VGX-3100和INO-9012。I/II期临床试验初步结果表明,DNA疫苗在局部晚期HPV相关HNSCC患者中产生HPV特异性CD8+T细胞免疫力,并且安全性良好。所有受试患者至少在一次测定中具有阳性细胞免疫应答。
正在进行的I/II期研究正在检测MEDI0457和抗PD-L1抗体durvalumab组合在HPV阳性复发/转移性HNSCC中的治疗疗效。
最近,一项II期试验表明,相较于未经治疗组,三种肿瘤睾丸抗原(LY6K, CDCA1和IMP3)多肽疫苗治疗的复发或转移性HNSCC患者显著生存获益(中位生存期4.9 vs 3.5个月, p<0.05)。
减毒细菌和病毒载体
ADXS11-001是一种减毒单核细胞增生李斯特菌(LM)-李斯特菌溶血素O(LLO)免疫治疗,正在进行的I/II期试验正在研究ADXS11-001和durvalumab组合相较durvalumab单一治疗的疗效。
DPX-E7是用于HPV阳性肿瘤治疗的HPV16-E711-19纳米疫苗。TG4001依据是携带和表达突变灭活HPV16E6和E7癌蛋白的修饰的痘苗病毒安卡拉。Ib/II期研究正在研究这种疫苗结合PD-L1抗体avelumab的治疗疗效。
DC疫苗
I期临床试验中,16名切除HNSCC的患者中,11名患者p53特异性T细胞频率增加,4名患者检测到干扰素γ分泌。疫苗接种后Treg比率下降。
总之,目前最成功的疫苗接种策略为HPV预防性接种。它们与其他免疫治疗策略,如检查点抑制剂组合可能更具前景。
细胞因子
白细胞介素2是由T细胞产生的主要促炎性细胞因子之一。它会增强活化T细胞的增殖和细胞毒性反应。HNSCC患者白细胞介素2治疗早期试验证实,细胞因子水平,肿瘤内NK细胞和TIL活性增加。淋巴管外注射白细胞介素2显着延长了HNSCC患者的无病生存期和总生存期,并且耐受性良好。然而,较早期试验表明,干扰素α2a和白细胞介素2组合具有明显毒性。
HNSCC细胞因子免疫治疗疗效显著,全身使用与大量毒性相关。然而,局部注射入肿瘤或区域淋巴结可能是一种具有前景的替代方案。嵌合构建体靶向细胞因子治疗毒性可能较小,这种方法目前正处于早期临床试验阶段。
Toll样受体
Toll样受体是识别病原体相关分子的模式识别受体亚群,是免疫功能的关键介质。TLR通常表达于免疫细胞,并引发局部炎症。临床前模型中,TLR激动剂具有深远的免疫刺激作用。莫托莫德(VTX-2337)是一种小分子TLR-8激动剂,可激活单核细胞,DC细胞和NK细胞。
HNSCC患者Ib期研究中,莫托莫德联合西妥昔单抗治疗总体反应率为17%,疾病控制率为50%。细胞毒性治疗失败后复发或转移性HNSCC患者随机II期试验比较了TLR-9激动剂EMD1201081与西妥昔单抗的疗效。TLR-9激动剂无递增临床功效。由于安全性问题,使用相同TLR-9激动剂和顺铂组合的另一项试验被提前终止。
细胞疗法
细胞疗法包括过继性细胞转移和CAR-T细胞治疗。过继性细胞转移涉及自体抗原特异性细胞毒性T淋巴细胞体外扩增以及回输前细胞基因修饰选择。CAR-T细胞用于诱导更强的抗肿瘤T细胞效应。这项新技术使用分离自患者外周血的初始T细胞。
CAR是由三部分(胞外抗原识别区,铰链和跨膜区以及细胞内T细胞激活结构域)组成的工程化膜蛋白。抗原识别部分由衍生自抗体免疫球蛋白重链和轻链高变区的单链可变片段组成。该片段与肿瘤相关抗原具有更高的亲和力,与通常来自CD3ζ链细胞质结构域的细胞内信号传导区相连。此外,共刺激分子在单链可变片段和CD3ζ链之间连接以改善T细胞活化。CAR治疗中,CAR在患者来源的T细胞中过表达。
免疫检查点抑制剂
截至目前,大多数靶向抑制性检查点受体的抗体已经进行了临床研究。这些药物可以重新激活抗肿瘤免疫反应,并且在多种实体瘤,如黑色素瘤,NSCLC和肾癌治疗中疗效显著。不同于常规肿瘤细胞导向抗体或化疗制剂,免疫检查点抑制剂不直接靶向癌细胞,而是与免疫细胞上的受体或其配体结合,从而调节其活性。重要地,即使停药后,这些药物也可以诱导晚期和转移性实体瘤长期缓解。
转移性HNSCC免疫检查点抑制剂治疗
Nivolumab和pembrolizumab是抗PD-1抗体。CheckMate 141试验比较了铂类治疗耐受、复发或转移性HNSCC患者nivolumab与标准治疗的疗效。结果显示,nivolumab显着延长了患者的总生存期,但无进展生存期无差异。Nivolumab组1年后生存期增加了一倍。生存获益与HPV状态无关,但p16阳性患者生存获益更强。Nivolumab治疗对PD-L1阳性患者的总生存影响更明显。Nivolumab组患者症状稳定,相较于化疗,nivolumab延缓了患者病情恶化的时间。PD-1抑制剂是复发或转移性HNSCC患者二线新标准治疗药物,相关试验结果以及正在进行的III期试验如表1和表2。
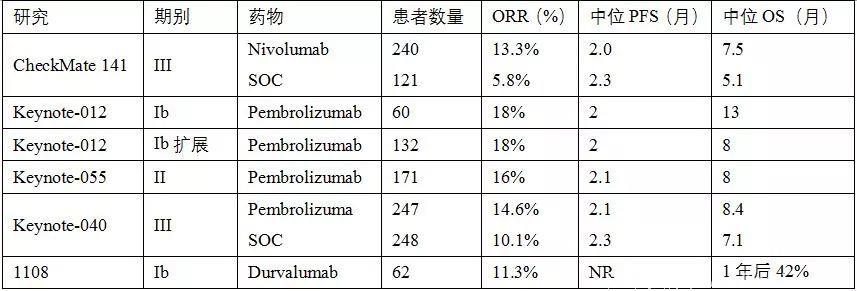
表1. 复发/转移性头颈鳞癌免疫检查点抑制剂治疗
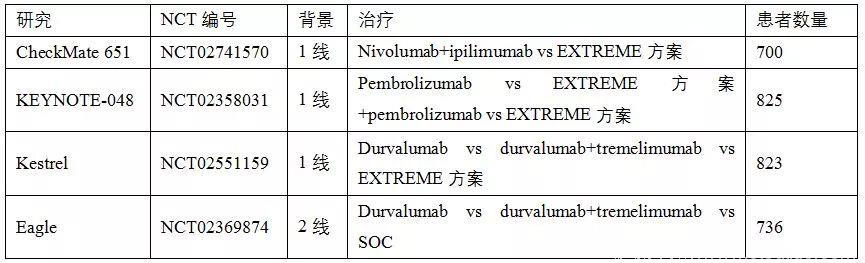
表2. 正在进行的III期免疫检查点抑制剂试验
局部及局部晚期HNSCC免疫检查点抑制剂治疗
当前局部晚期HNSCC标准治疗方案是肿瘤切除,然后放疗或铂类化疗(CRT)。放疗联合铂类化疗或西妥昔单抗以保护器官是一种良好的替代方案。一项试验研究了pembrolizumab和限定性CRT组合的疗效。
提交中期分析时,21名患者接受了计划剂量的pembrolizumab。3名患者因免疫相关不良事件停止治疗,3名患者因协议原因停止治疗。所有患者在无显著延迟情况下完成了全部剂量化疗。23名患者接受了目标剂量的顺铂。CRT开始后第150天,21名患者完全缓解,4名患者部分缓解,1名患者疾病进展。该研究目前正在招募患者进行进一步疗效分析。目前正在进行局部晚期HNSCC免疫检查点抑制剂治疗试验。
其他表达于T细胞的免疫检查点蛋白包括BTLA(B和T淋巴细胞衰减剂),LAG-3和TIM-3。阻断这些蛋白与其配体结合的抗体正处于临床研发和检测阶段。
免疫检查点激活剂
相较于抑制性检查点受体抗体,T细胞上的肿瘤坏死因子受体超家族成员活化可诱导免疫刺激作用。迄今为止,研究最多的刺激性检查点受体及其配体是OX40(OX40-配体),CD137(4-1BB配体)和CD27(CD70)。
OX40表达于活化的T细胞。通过活化抗体刺激OX40会抑制T细胞凋亡,诱导产生免疫刺激性细胞因子。一项正在进行的临床试验正在研究HNSCC患者辅助治疗OX40激动剂MEDI6469。其他OX40激动剂(MEDI0562,PF-04518600)正处于不同实体瘤I期临床试验中。
Urelumab是CD137激动剂抗体,I期研究正在检测urelumab和西妥昔单抗组合治疗HNSCC与结直肠癌的疗效。另外,临床前研究表明,urelumab增强了西妥昔单抗活化的NK细胞存活,DC细胞成熟和肿瘤抗原交叉呈递。Varlilumab是一种CD27激动剂,目前正处于与nivolumab和atezolizumab组合应用临床试验阶段。JAVELIN Medley试验是一项Ib / II期试验,研究了PD-L1 抑制性抗体avelumab联合其他不同的癌症免疫疗法,包括PF-04518600和抗4-1BB抗体utomilumab的疗效。
文章编译自:Uta Rothschild, Laurent Muller, Axel Lechner, Hans A Schlösser, Dirk Beutner, Heinz Läubli, Alfred Zippelius, Sacha I Rothschild. Immunotherapy in head and neck cancer – scientific rationale, current treatment options and future directions. REVIEW ARTICLE: BIOMEDICAL INTELLIGENCE. May 2018.
1.医学前沿丨Nivolumab是否可使cHL患者长期获益?
2.专家视角 | 陈公琰教授:NSCLC IO治疗的特殊人群:老年患者
3.时代递进——晚期NSCLC关键治疗的演变历程