专家论坛|脑微出血与抗栓治疗

作者:倪俊1,崔丽英1,2
单位:
1北京协和医院神经科
2中国医学科学院神经科学中心
通信作者:崔丽英
文章来源:协和医学杂志,2018,9(2):112-117.
脑微出血可同时增加缺血性和出血性卒中发生风险,尤其在接受抗栓、抗凝和溶栓治疗的患者中,脑微出血的存在显著增加了抗栓相关出血风险,然而增加的出血风险是否可抵消或超过抗栓所带来的临床获益呢?在抗栓与出血风险中如何权衡呢?
北京协和医院神经科倪俊及崔丽英教授在《脑微出血与抗栓治疗》一文对相关风险进行了阐述和分析,现分享主要内容如下~
脑微出血与抗栓治疗
脑微出血的定义
脑微出血(CMBs)是指慢性小灶性血液分解产物(主要物质为含铁血黄素)沉积在脑组织内形成的微小病灶,在磁共振梯度回波序列上呈现低信号,是脑小血管病的出血性影像学标志物之一。
脑微出血的病因及临床意义
病因:多种疾病或病因可导致CMBs的发生。目前公认最常见的两种病因是高血压小动脉病变和脑淀粉样血管病。
影像特点:
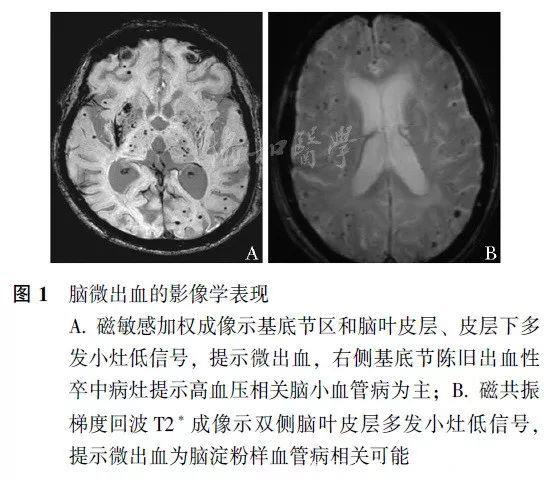
(图片来自于《协和医学杂志》)
高血压小动脉病变所致CMBs:
常分布于脑深部包括基底节区、丘脑和脑干(图1A),有时累及脑叶和小脑,与病理上高血压常累及深部穿支动脉及其分支有关。
CAA相关CMBs:
常位于脑叶(图1B),且后部(枕叶)受累更重,与CAA 为进行性β淀粉样蛋白沉积于皮层和柔脑膜的小血管管壁且后部受累更重相关。高分辨7T-MRI研究发现,这些位于脑叶的CMBs绝大多数位于皮层。
临床意义:
针对局限脑叶CMBs对CAA的诊断价值,2015年发表的一项CMBs影像与病理对照研究结果显示,对于医院人群,局限脑叶CMBs对CAA的诊断具有较高敏感性、特异性及阳性预测值,但迄今并未将局限脑叶CMBs写入CAA的波士顿诊断标准中。其他可导致CMBs的原因包括危重症疾病累及中枢神经系统、弥漫性轴索损伤、高海拔脑水肿、放射性脑损伤、感染性心内膜炎、血栓性血小板减少性紫癜等,不同原因所致的CMBs在影像学分布特征上存在差异,了解这些分布特征对于病因诊断及进一步防治具有重要意义。
脑微出血与卒中发生/复发风险
CMBs作为危险因素同时增加缺血性和出血性卒中的风险,且这种风险随年龄增长逐渐增加。不同人群中,CMBs预测卒中风险均有研究报道。
在社区人群中,来自日本的老年人群研究共入组2102人,基线脑微出血患病率4.4%,平均随访3.6年,发现CMBs预测出血性卒中的风险比(HR)为50.2(95% CI:16.7~150.9),预测缺血性卒中的HR为4.48(95% CI:2.20~12.22),尽管如此,CMBs患者出血性卒中的绝对风险仍相对较低(2~3/1000人·年),因此其临床意义仍需进一步评估。
迄今最大的影像前瞻性队列研究即鹿特丹社区人群研究,基线4759人中CMBs占18.7%,平均随访4.9年,93人发生卒中(2.0%)。
结果显示:基线存在CMBs增加总的卒中风险(HR=1.93,95% CI:1.25~2.99),且多发CMBs使卒中风险进一步增加,而CAA相关局限脑叶CMBs仅增加出血性卒中风险(HR=5.27,95% CI:1.38~20.23)。
这些前瞻性研究均提示,与基线无CMBs的患者相比,存在CMBs及其负荷同时增加缺血性和出血性卒中风险,而局限脑叶的CMBs可能仅预测出血性卒中风险。
在缺血性卒中队列中进行的CMBs与未来卒中风险的研究也得出了相似结论。
一项荟萃分析纳入已发表的10个队列共3067例卒中/TIA患者,评估CMBs与卒中风险的关系,发现存在CMBs与任何类型的卒中复发均显著相关(OR=2.25,95% CI:1.70~2.98,P<0.0001),进一步按照种族进行亚组分析发现,亚洲人群CMBs与出血性卒中关系更密切,而在欧美人群中,CMBs主要增加缺血性卒中复发风险,提示人种差异可能影响了CMBs对卒中的预测价值。
近期一项共纳入5068例缺血性卒中患者(其中79%口服抗血小板药物,15%抗凝治疗)的荟萃分析结果显示,与基线无CMBs患者相比,存在CMBs同时增加缺血性和出血性卒中风险,且风险度随CMBs的负荷增加而增加,但出血性卒中风险增加幅度更大。
此外,对于CMBs是否影响出血性卒中患者复发风险,近期一项纳入包括1306例出血性卒中患者(325例为CAA相关)共10个研究的荟萃分析结果显示,基线存在CMBs或CMBs负荷与出血复发显著相关;进一步按照CMBs的部位进行分析,任何负荷的脑叶CMBs可预测出血复发,而对于深部CMBs,仅高负荷CMBs(>10个)才能预测出血复发,提示不同病因/机制的CMBs对出血性卒中患者复发的预测价值不同,进一步临床决策可能存在差异。
脑微出血与抗栓相关出血风险
CMBs增加抗血小板相关出血风险已有研究报道。
2003年香港学者报道了使用阿司匹林的患者中,出血性卒中组较无出血性卒中组CMBs患病率更高(19%比7%, P<0.001),负荷更重(平均CMBs数13.3比0.4, P<0.001),因此认为CMBs可能是抗血小板相关出血性卒中的危险因素。
2010年,来自欧洲的病例对照研究得到相似的结论,调整年龄、性别及高血压后CMBs在使用阿司匹林合并出血性卒中组显著高于阿司匹林无出血性卒中组,同时发现脑叶CMBs可独立预测抗血小板治疗相关出血性卒中的风险(OR=1.42)。
上述研究共同之处是CMBs多位于脑叶,提示CAA的可能性,推测CAA可能增加抗血小板相关出血性卒中的风险。
华法林治疗可为存在CMBs的患者带来更高风险的间接证据。
长期以来,非瓣膜房颤口服华法林或新型口服抗凝药预防缺血性卒中已被广泛认可且被指南推荐。然而随之而来的抗凝相关出血性卒中值得关注。抗凝相关出血性卒中的危险因素包括年龄、抗凝药物剂量、高血压、脑血管病病史、CAA、CYP450基因多态性、合并抗血小板治疗和CMBs等。与基线期影像学上无CMBs的患者相比,存在CMBs的患者抗凝治疗后出血性卒中的风险显著增加。
近期一项CMBs与抗凝相关出血性卒中关系的荟萃分析,纳入8个中心共1552例房颤伴卒中接受抗凝治疗患者的结果显示,与无CMBs相比,基线存在CMBs(OR= 2.68, 95% CI:1.19~6.01,P=0.017)以及存在≥5个CMBs(OR=5.50, 95% CI: 2.07~14.66, P=0.001)的患者抗凝治疗相关年出血性卒中风险均显著增加。进一步针对CMBs分布进行分析显示,仅局限脑叶的CMBs与出血风险增加相关(OR=2.88, 95% CI:1.14~7.23,P=0.025),深部CMBs与抗凝后出血性卒中的发生无显著相关性,提示临床上多发局限于脑叶的CMBs患者抗凝治疗的出血风险高,值得关注。
另一项纳入1460例出血性卒中和3817例脑梗死/TIA患者的系统综述,逐个病例对比分析发现,CMBs在华法林相关出血性卒中中较自发性出血性卒中组更常见(OR=2.7,95% CI: 1.6~4.4,P<0.001)。
这些研究提供了华法林治疗可为存在CMBs的患者带来更高风险的间接证据。
CMBs是否增加溶栓后出血风险?
这也是近年来备受争论的临床问题。早期来自巴西的570例溶栓患者汇总分析认为CMBs并不增加溶栓后出血风险,可能的解释是影像学条件限制了CMBs 的识别。2015年和2016年两项荟萃分析分别纳入8个和9个溶栓队列研究,结果一致显示基线存在CMBs可独立预测溶栓后出血风险,且随CMBs负荷增加,出血风险进一步增加。
虽然结论显而易见,但CMBs所致出血风险增加是否能抵消溶栓带来的获益,仍有待进一步研究。
另一项研究发现,CMBs并不影响卒中溶栓3个月功能预后。值得注意的是,局限脑叶的CMBs高度提示CAA可能,理论上溶栓后出血风险更高,临床是否应避免对CAA患者进行溶栓治疗仍无明确证据。
因此,在缺乏前瞻性随机对照研究前,指南并未推荐溶栓前常规进行磁敏感序列评估多发脑叶微出血的存在。但在临床溶栓决策时,对于既往影像存在多发局限脑叶CMBs或明确诊断CAA的患者,应尽可能避免溶栓。
脑微出血患者抗栓治疗的获益与风险
CMBs患者长期抗栓治疗可增加出血性卒中风险,但由于抗血小板或抗凝治疗明确减少非心源性或心源性卒中复发风险,因此CMBs增加的出血风险是否已超过抗栓治疗获益尚未明确,是亟待回答的临床难题,需要更多量化数据进行评估。有限的证据表明,CMBs的部位和负荷是决定患者能否从长期抗栓治疗中获益的重要因素。
2008年,韩国Soo等对908例脑梗死接受抗栓治疗的患者进行平均26.6个月的随访,试图分析存在CMBs卒中抗栓治疗的获益和风险比,结果发现即使基线存在CMBs,卒中患者仍能从二级预防的抗栓治疗中获益;但随着CMBs数量增加,相关出血和死亡风险随之显著增加,尤其当CMBs超过5个时,风险可超过抗栓获益。来自欧洲的一项前瞻性队列研究共入组487例急性卒中或TIA患者,发现基线CMBs卒中复发风险高于出血性卒中风险。上述结论仍需扩大样本量的前瞻性研究进一步证实。
此外,CMBs的分布也是影响抗栓获益与出血风险的重要因素,高血压小动脉病变和CAA所致CMBs的病理机制及临床表型存在显著差异,高血压相关小动脉病变是出血性和缺血性卒中的共同危险因素,高血压同时可导致大动脉粥样硬化继而增加缺血性卒中风险,这部分患者抗栓治疗的需求及获益均明显增加,鉴于此,患者即使存在深部或脑干CMBs,由于其潜在的抗栓获益大于出血风险,因此不影响二级预防抗栓治疗决策,但为了降低出血性卒中风险,控制其他增加出血风险的危险因素必要且可行,如严格控制血压、戒烟、戒酒及避免药物滥用等。
另一方面,CAA所致的局限脑叶CMBs,易导致症状性脑叶出血,而CAA本身发生缺血性卒中并不常见,因此,局限脑叶CMBs的CAA患者并不能从抗栓中获益,反而增加出血性卒中的风险。但是由于CAA的老年人可能同时合并动脉粥样硬化及血栓风险,临床上可能存在抗栓治疗的需求,因此更需权衡抗栓的获益风险比,决策困难。由于迄今尚无局限脑叶CMBs或CAA的患者抗栓治疗与未来获益风险的前瞻性研究发表,临床仍需个体化评估抗栓的必要性和出血风险,以采取合理的治疗决策。
对于抗栓必要性和卒中风险的综合评估,临床上可应用包括针对TIA早期卒中发生风险的ABCD2评分,针对非瓣膜性房颤卒中风险评估的CHA2DS2-VASc评分,并结合影像学的卒中病因分型等综合评估抗栓治疗需求和获益,而房颤患者抗凝治疗的出血风险可应用HAS-BLED评分量表评估,进行影像学检查评估CMBs的部位及负荷、白质高信号程度,同时评估血压、饮酒史等可能的出血风险,综合上述因素对患者进行血栓和出血风险的全面评估,从而个体化决策治疗方案。
例如一例非瓣膜房颤需要抗凝的患者,CMBs并不能作为抗凝治疗的禁忌,但如果多发局限脑叶CMBs,提示出血风险高,可能抵消华法林治疗的临床获益,可选择出血风险较小的新型口服抗凝药或左心耳经皮封堵术,并严格监测和控制血压,使患者最大程度获益。
小结
CMBs的存在可同时增加出血性和缺血性卒中风险,此时抗血小板、抗凝和溶栓治疗进一步增加出血性卒中风险,但已有证据并未明确这些增加的出血风险是否超过抗栓治疗带来的获益。
因此,2017年美国卒中学会发表的关于无症状脑血管病的科学声明指出,CMBs的存在并不能改变现有的一级预防和二级预防总的抗栓决策,抗栓、抗凝或溶栓治疗前无需常规磁敏感序列筛查CMBs。
但既往证据和经验均提示,局限脑叶的CMBs以及较高的CMBs负荷使患者抗栓治疗后出血性卒中风险显著增加,部分患者抗栓治疗的获益可能被出血风险抵消,临床工作中识别出血风险高的患者并给予个体化临床决策非常关键。
期待正在进行的CROMIS-2研究可以回答CMBs与卒中及抗栓治疗的更多问题。未来针对CMBs对抗栓治疗获益和风险影响的大样本前瞻性随机双盲对照试验,能够更加精准地指导临床工作。
第一作者简介

倪俊
北京协和医院神经科主任医师,教授,硕士生导师。
主要研究方向:脑血管病、脑淀粉样血管病、少见原因脑血管病(烟雾病、烟雾综合征、静脉窦血栓、血管炎、青年卒中等)。
通信作者简介

崔丽英
北京协和医院神经科主任, 教授,中华医学会神经病学分会现任主任委员,中国医师协会神经内科分会副会长,北京医师协会神经病学分会会长。国际临床神经电生理联盟(IFCN)执委。中华神经科杂志名誉总编,《中华医学英文版》、《协和医学杂志》等六个杂志副主编。发表学术论文500余篇,著书20余本。

版权声明:
协和医学杂志倡导尊重和保护知识产权。欢迎转载、引用,但需取得本平台授权。如您对文章内容版权存疑,请发送邮件[email protected]
