面对“受试者荒”,癌症研究员希望放宽临床试验标准

在美国,近20%的公共资助的癌症临床试验失败了,研究员无法招募到足够多的受试者。那是因为美国的患者少吗?并不尽然,而是因为很大一部分患者无法通过FDA所制定的临床试验标准,这让他们和医生都无能为力。
因此,现在研究人员正准备修订冗长的临床试验标准列表,希望能够去除一些不必要的,阻碍研究的规则。4月16日,FDA的代表将会见华盛顿的研究人员代表,讨论限制性临床试验资格标准今后将如何筛选患者。他们还计划利用它收集的信息为药企制定指导方针。
纽约纪念斯隆凯特林癌症中心的肿瘤学家Stuart Lichtman认为:“即便你有着绝妙的想法和严谨的实验方式,但如果没人参加这项研究,那也无异于空中楼阁。”临床标准的限制一开始的出发点都是为了保护受试者。比方说,有一定程度肝功能衰竭的病人可能不允许参加一些通过肝脏代谢的药物,标准也要排除那些可能会混淆研究结果的人。
但一些研究人员认为,随着时间的推移,科学家们通常会将之前的试验标准作为他们下次研究的模板。这种“只增不减”的做法使得临床实验的要求越来越多,将带来许多不必要的限制。
限制一:患者范围太小
德州大学达拉斯分校西南医学中心的肺癌专家David Gerber发现,由美国国家癌症研究所赞助的80%的临床试验都排除了之前接受过治疗的癌症患者。但在很多情况下,以前的癌症可能早在肺癌发现之前就已经被发现并被成功治疗。这种限制让很多真正的病人无法得到接受治疗的资格。
FDA与美国临床肿瘤学会(ASCO)联合开展的一项联合项目发现,5个常用的癌症试验资格标准是可以被修改的,而且并不会影响受试者以及试验的完整性,该团队在去年10月公布了调查结果。
例如,艾滋病病毒感染者因其预后不良而被排除在试验之外。现在,通过治疗,他们常常和没有病毒的人一样长寿,并且应该被纳入许多癌症试验中。研究小组还建议,在某些情况下,研究人员应该放松对器官功能障碍患者的限制,尤其是对于包括美国在内的一些存在老龄化问题的国家。
限制二:拒绝未成年患者
此次另一个引发争议的修改是将许多成人癌症试验的资格年龄从18岁降至12岁。这反映了对基本药物代谢的理解,因为从现在的研究看来,人的身体在12岁时的药理学代谢方式与18岁时并没有什么区别。
但是一些成人癌症医生可能并不想收录未成年人,因为这种治疗通常在专门的儿童医院进行,与成人临床试验不同。此外,大多数青少年癌症是罕见的,并且即使是在同一器官中也可能与成人癌症不同。虽然这对于整体研究的影响不大,但仍然可以帮助那些可能被排除在试验之外的未成年人。
许多大型制药公司的研究人员,都急于在即将到来的试验中做出改变。如果这个建议今后成为了一个有影响力的方案,那些人口老龄化的国家,比如日本和意大利,将会重新评估自己的临床试验标准。
如何在ClinicalTrials.gov检索试验
如果是一个刚接触临床试验的医生,可以利用ClinicalTrials,可参考他人的研究内容,详细分析每一项研究的意义,并借鉴用于自己的研究设计,提高研究设计的质量。在ClinicalTrials上的检索其实很简单,有使用PubMed的基础后,立马就能上手。
第一类是简单检索,只要在首页的搜索框里输入检索内容就行,和PubMed一样可使用AND、OR、NOT等逻辑运算。
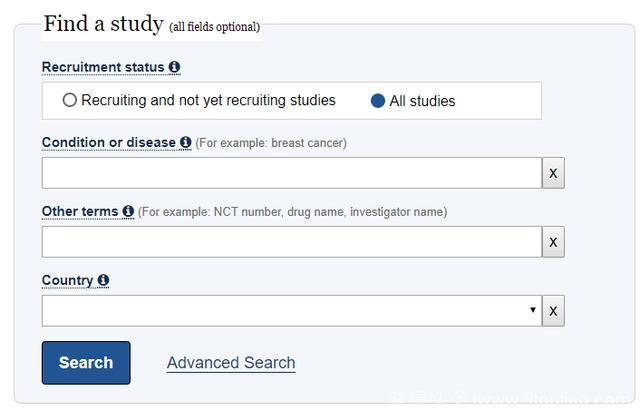
第二类是高级检索,点击Advanced Search开启。