投资肿瘤疫苗的春天到来了吗?
2017年9月,BavarianNoridc公司宣布其肿瘤疫苗产品Prostvac三期临床试验失败。至此,二十几年来的肿瘤疫苗研究领域成果惨淡。专家预判,目前仍在进行中的三期临床试验也多半会以失败告终。
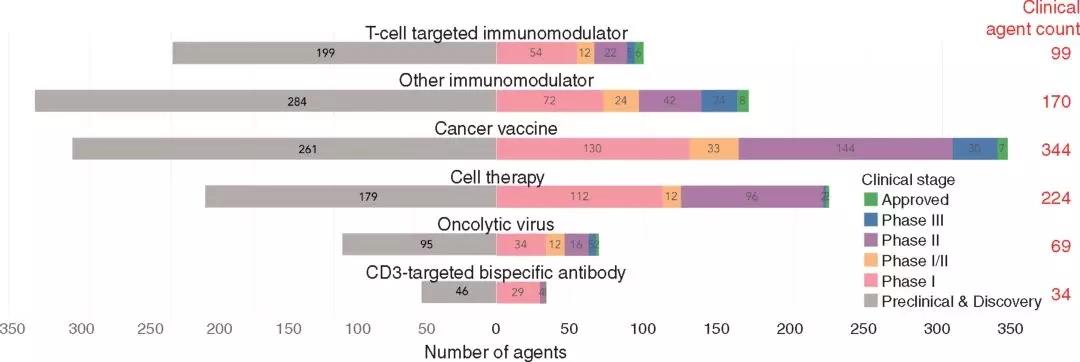
▲图1:肿瘤免疫疗法的临床试验概况(AnnOncol.2017;29(1):84-91)
那么,肿瘤疫苗研究的问题出在哪里,是理论短板还是技术壁垒,其希望和契机又在哪里,笔者在此就带大家一探究竟。
肿瘤免疫战场上的几员大将
T细胞无疑是肿瘤免疫治疗战场上的一员大将,属于直接与肿瘤君对战厮杀的前线队员,但是这名前线队员要发挥作用,离不开抗原呈递细胞(Antigenpresentingcell,APC)的帮助。
在一个自然的免疫反应过程中,异己成分(抗原)进入人体,会被成熟的APC细胞吞噬、“剪碎”后“安插”在细胞表面的抓手(MHC)上,这些APC细胞带着“敌人的残骸”游走到免疫大将T细胞所在地,那些能够识别这些“敌人残骸”的T细胞被激活,继而疯狂扩增出成千上万个跟自己一样能够识别敌人残骸的分身。这支免疫大军带着自己的特异性武器,找到并认出这些“异己成分”,将其裂解、消灭。
这支免疫大军有严格的自律系统,能够自我抑制以免过强的免疫反应伤及自身。多数T细胞在消灭敌人后也随之死去,只留下少数“巡逻兵”,在将来再次遇见同一个敌人时迅速反应。
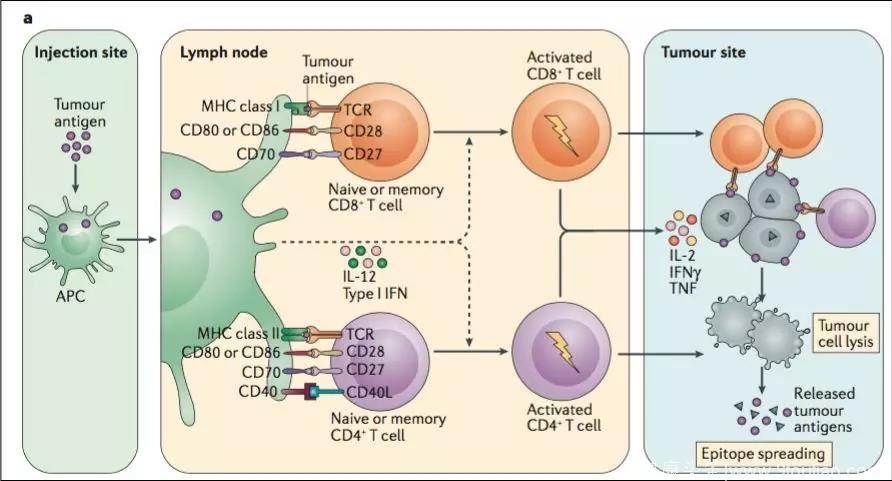
▲图2:肿瘤抗原呈递过程 (NatRevImmunol,2017Dec)
然而,肿瘤并非完全的“异己成分”。
与正常组织相比,肿瘤细胞往往过表达那些能够让自己不断增殖的蛋白,然而这些蛋白仍属于自身成分,所以免疫细胞对这些蛋白的反应能力有限。
肿瘤细胞与其周围的基质细胞狼狈为奸,创造出低氧、低糖、低pH值的肿瘤微环境,抑制免疫细胞发挥作用。
狡猾的肿瘤细胞还利用了T细胞的自我抑制机制,过表达抑制T细胞反应的分子(PD-L1),最终实现“免疫逃逸”,安稳地活在免疫细胞的眼皮底下。
最近很火的免疫检查点抑制剂,就是抑制肿瘤细胞表面的抑制分子(PD-L1),或者T细胞上这些抑制分子的受体(PD-1),将T细胞从被抑制的状态中解救出来。
CAR-T疗法,则是通过基因修饰的方法,直接修改T细胞表面识别“敌人残骸”的受体,让T细胞更加有效地发现/找到敌人。
目前,这两种肿瘤免疫疗法都取得了突破性的进展,与这两种免疫疗法同步火热进行的研究还有一项,肿瘤疫苗。
肿瘤疫苗的四个要素
传统意义上的疫苗主要是起预防作用,在疾病发生之前,给人体输入病原体的一部分“残骸”,因为是残骸,所以杀伤力骤减,不具有致病性。人体内的APC将这些残骸呈递给T细胞,T细胞扩增并留下一小部分记忆细胞,当人体再次遇到同种病原体的侵害,就能够迅速地反应并将其控制。
已经上市的肿瘤预防疫苗(preventivevaccines)包括针对人乳头瘤病毒的Gardasil(Merck)、Gardasil9(Merck)、Cervarix(GSK);以及针对肝炎病毒的Engerix-B、RecombivaxHB等。人乳头瘤病毒与宫颈癌、阴道癌等的发生密切相关,而慢性肝炎则与肝癌的发生密切相关。
除此之外,绝大多数肿瘤的发生都并非外来病原体(细菌、病毒等)导致的,因此肿瘤疫苗的研究火力主要集中在治疗性疫苗(therapeuticvaccines)方面。
要想读懂市场上纷繁复杂的肿瘤疫苗,需要了解四个要素。
一 肿瘤抗原(tumorantigen)
人体的免疫细胞在成熟之前,经历了严格的筛选过程,那些对自身成分反应不足或反应过于强烈的T细胞都会死亡。
与正常细胞相比,肿瘤会过表达某些蛋白的表达,这些过表达的蛋白超过一定限度便有可能被免疫细胞察觉,触发免疫反应。此类在正常细胞中也有表达,但是在肿瘤细胞中过度表达的蛋白被称为“肿瘤相关抗原”(tumorassociatedantigens,TAAs)。
例如肿瘤高表达的表皮细胞生长因子HER2、端粒酶逆转录酶TERT、抗凋亡蛋白survivin,以及乳腺癌高表达的mammaglobin-A,前列腺癌高表达的PSA,黑色素瘤高表达的MART1等。
需要引起注意的是,这些抗原仍属于自身成分,因此免疫细胞对其识别和反应能力有限,而且这些蛋白在正常组织中也有表达,一旦触发免疫反应可能会损伤正常组织。
当肿瘤细胞发生基因突变,会产生区别于自身的异己成分,这类抗原被称为“肿瘤特异性抗原”(tumorspecificantigens),又被称为neoantigens。这类抗原明显区别于自身成分,能够更有效地触发免疫反应,而且不会伤及自身。
二 制剂(formulation)
肿瘤疫苗的目的在于人为向患者体内输入抗原,训练人体免疫系统识别、攻击肿瘤细胞的能力。而引入肿瘤抗原的形式多种多样,主要分为基于整个肿瘤细胞的疫苗和基于特定肿瘤抗原的疫苗。
基于整个肿瘤细胞的抗原是将辐射过(使其丧失增殖能力)的自身肿瘤细胞或者已经建立的永生化细胞系细胞回输给患者。
基于特定肿瘤抗原的疫苗是将能够引起免疫反应的肿瘤细胞的一部分,如蛋白、肽段、核酸等回输给患者。
根据肿瘤抗原来源的不同,又可以将肿瘤疫苗分为自体来源(autologous)或者异体来源(allogeneic)两类。
自体来源的肿瘤疫苗属于个体化疫苗,利用患者自身的肿瘤细胞作为抗原来源,标准化生产难度大、成本高;异体来源的肿瘤疫苗利用不同患者甚至不同肿瘤表达的同种抗原,或者已经建立的永生化肿瘤细胞系作为抗原来源,可批量生产,成本大大降低。
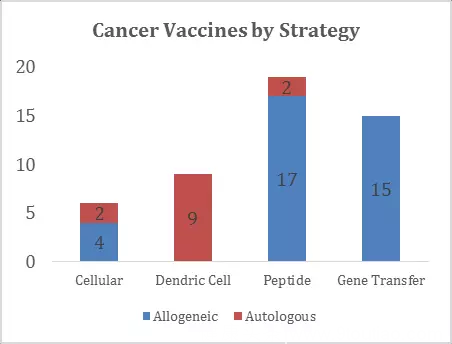
▲图3:不同制剂类型的在研肿瘤疫苗
(Report:CancerVaccineTherapeutics:FailuresandFutureOpportunities)
对在研项目的分析表明,基于生产成本考虑,多数疫苗产品为异体来源(>70%),而基于抗原呈递细胞APC(树突细胞DendriticCell是APC的一种)的肿瘤疫苗全部为自体来源。

▲图4:不同制剂类型的在研肿瘤疫苗优缺点
(Report:CancerVaccineTherapeutics:FailuresandFutureOpportunities)
四 佐剂(adjuvants)及输送(delivery)
只有成熟的APC细胞才能将抗原呈递给T细胞,用于激活患者体内的APC细胞的物质称为佐剂(adjuvants)。
大量研究表明,目前最有效、最常用的佐剂是GM-CSF,通常将GM-CSF与肿瘤抗原一起皮下注射,对于基于肿瘤细胞的疫苗(例如GVAX)常将GM-CSF的基因整合入肿瘤细胞的基因组,使其能够自行分泌GM-CSF。
肿瘤抗原和佐剂需经由适当的输送系统进入体内。
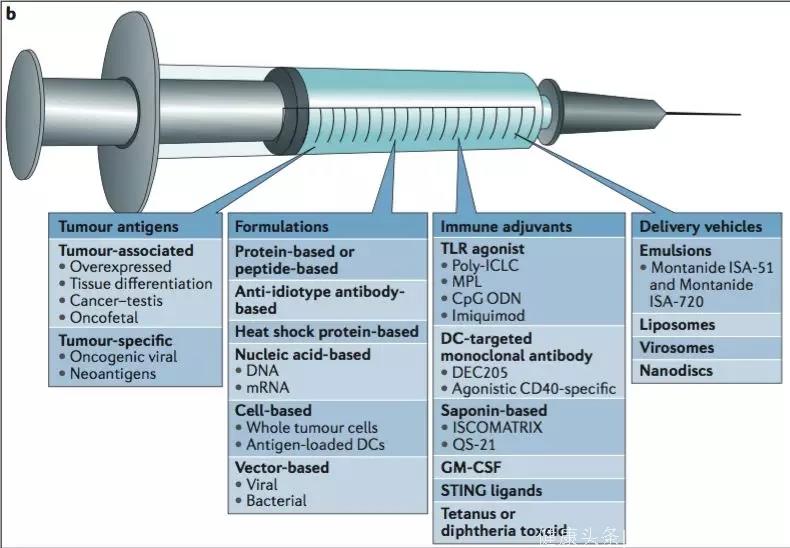
▲图5:肿瘤疫苗的四个要素(NatRevImmunol,2017Dec)
治疗性肿瘤疫苗市场上的一枝独秀——Provenge
2010年4月,FDA批准Dendreon公司的肿瘤疫苗产品Stipulencel-T(Provenge)用于转移性、去势耐受型前列腺癌(metastaticcastrationresistantprostatecancer)的治疗,Provenge成为美国市场第一个,也是迄今为止唯一的治疗性肿瘤疫苗。
Provenge将患者自身的外周血单核细胞与肿瘤抗原PAP-GM-CSF融合蛋白共同培养,然后回输给患者。临床试验结果显示,Provenge将患者的总体生存期延长4.1个月。
1992年,斯坦福大学免疫学家EdgarEngleman和SamuelStrober成立了Dendreon公司。当时,利用人体自身免疫系统对抗肿瘤的概念仍存在很大的争议,Strober说:“当时的公司都是建立在对理论的希望上,而不像现在以经济利益为核心”。
2010年FDA对Provenge的批准,与其说是经济上的成功,更应该说是对科学界的鼓励,其既证明了可以利用患者自身的免疫系统对抗肿瘤的可行性,又证明了成分复杂、基于患者自身的个体化治疗通过政府审批的可能性。
然而,这一历史性突破并未促使整个肿瘤疫苗研究领域开花结果,更没有带来大家所期盼的经济效益。
由于医保和报销政策的混乱,每疗程73000美金的高价,高昂的生产成本,以及当时激烈的竞争市场(同期FDA批准赛诺菲的Cabazitaxel和强生的abiraterone用于去势耐受型前列腺癌的治疗),Dendreon公司最终破产。2015年2月23日,加拿大公司ValeantPharmaceuticalsofLeval以41.5亿美金的价格买下了Provenge。
牺牲惨烈的肿瘤疫苗试验
截至2017年,与Provenge同期开展的肿瘤疫苗临床试验绝大多数已经结束,如下表格总结了III期临床试验的产品及其结果。多数走到III期临床试验的肿瘤疫苗针对前列腺癌、乳腺癌、非小细胞肺癌及黑色素瘤。绝大多数肿瘤疫苗III期临床试验以未见总体生存期改善而失败。
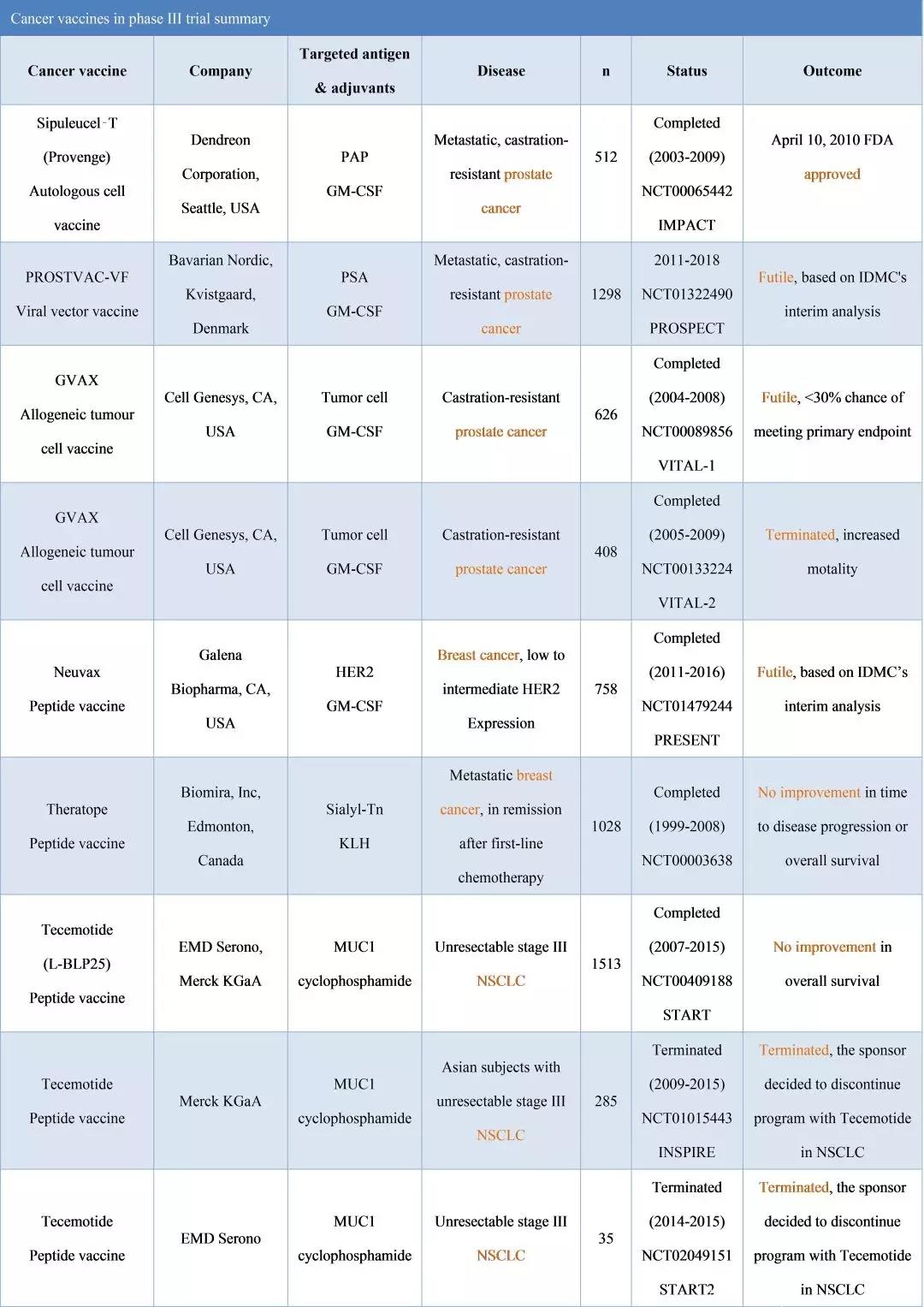
▲图6:III期肿瘤疫苗产品及试验结果(NatRevImmunol,2017Dec)
经验与教训
理论匮乏与经济诱惑
如上涌现的一大批临床试验(始于1990-2000年)都是基于“利用患者自身免疫系统来对抗肿瘤”这一酷炫的理念上的,当时科学界对免疫系统与肿瘤之间的相互作用机制并不清晰,1994年人类才发现第一个肿瘤相关抗原MAGE1,1992年发现PD1,而直到1999年才发现PD-L1。
此外复杂多样的肿瘤抗原、制剂类型、佐剂、输送系统导致了肿瘤疫苗的多样性,学术界缺乏对各类肿瘤疫苗产品的疗效系统、规范的比较研究;而当时对肿瘤疫苗的分子作用机制也知之甚少。
另外一个因素是经济诱因,疫苗属于安全性较高的生物制品,虽然许多疫苗产品的早期临床试验效果并不显著,但是许多公司仍然争相开展了大规模的临床试验。TherionBiologics公司更是直接将PANVAC从临床I期跳到了多中心III期试验。PANVAC针对进展迅速的胰腺癌,III期临床试验并未显示出生存期优势,公司于2006年破产。
微弱的免疫反应与抑制性肿瘤微环境
已经失败的或仍处于临床研究阶段的疫苗多基于肿瘤相关性抗原,即正常细胞中也有表达,只是肿瘤细胞表达量上调的蛋白,这些蛋白仍属于自身成分。
人体T细胞在成熟的过程中经历了严格的筛选过程,那些对自身成分识别过强的细胞都会发生凋亡,以避免自身免疫疾病的发生。因此人体内存活下来的T细胞对肿瘤相关性抗原的反应能力有限。
其次,在给予肿瘤疫苗时,肿瘤细胞及其周围细胞往往已经建立了强大的免疫抑制环境,即便疫苗可以通过APC细胞的帮助最终激活T细胞,但是如果抑制性的肿瘤微环境阻挡T细胞的进入,或者抑制T细胞的功能,肿瘤疫苗还是无法达到预期效果。
临床试验设计的几点提示
虽然众多肿瘤疫苗临床试验牺牲惨烈,但是这些失败的试验却是开展新一轮肿瘤疫苗研究的宝贵财富。区别试验失败是由于产品本身的缺陷还是试验设计出了问题至关重要。
1.寻找最优剂量
对于化学药物而言,剂量多与疗效呈正向相关关系,而生物制品往往并非如此。Oncophage是一种基于患者自身的多肽疫苗,动物实验表明剂量对于疗效至关重要,剂量过低或者过高均无法达到最优效果,然而Agenus公司设计临床试验时,并未进行剂量对比研究,而是直接选择了单一剂量。
2.早治疗
对多项临床试验的结果分析表明,虽然疫苗治疗并未显著改善患者的总体生存期,但是根据疾病进展阶段对患者进行分层分析可以发现,较早接受疫苗治疗的患者确有受益。以GVAX为例,CellGenesys称,VITAL-1及VITAL-2临床试验中,仅对预计生存期超过18个月的患者进行分析,接受疫苗的患者生存期优于对照组。
3.足够长的临床试验周期
由于肿瘤疫苗利用人体自然的免疫过程,其发挥疗效一般需要3-4个月的时间,且有可能需要进行多次免疫,因此,设计试验时,应考虑周期的充分性。
4.选择合适的试验终点
实体瘤反应性标准(ResponseCriteriainSolidTumors,RECIST)将肿瘤体积缩小作为评价新治疗方法有效性的主要标准,然而该标准对于肿瘤疫苗产品可能并不适用。很长一段时间内肿瘤疫苗可能不会导致肿瘤体积的缩小,却能够延长患者的无进展生存期。
如果说约始于1990年的肿瘤疫苗研究是一场规模巨大、成本高昂的试错研究,那么随着人们对免疫系统与肿瘤之间相互作用的分子机制的理解,发现肿瘤特异性抗原的技术性突破,免疫检查点抑制剂与CAR-T研究的巨大成功,对肿瘤疫苗临床试验设计的深入认识,肿瘤疫苗研究已经迎来春天,新一轮肿瘤疫苗研究有望提供新的免疫治疗解决方案。
技术突破与个体化疫苗
相比于肿瘤相关性抗原,多项研究表明,寻找肿瘤细胞基因突变产生的肿瘤特异性抗原(neoantigen)或是解决之道。
这些抗原仅在肿瘤细胞中表达,属于完全的异己成分,能够有效激活免疫系统。同种肿瘤不同患者,甚至同一患者体内的不同肿瘤基因异质性(heterogeneity)很高,单一一种肿瘤抗原可能不足以引发有效的免疫反应,因此,针对多种肿瘤特异性抗原的个体化疫苗将成为新一轮肿瘤疫苗研究的热点。
而近期两大技术突破使该研究成为可能,即新一代基因测序技术与生物信息学的强强联手。
提取患者肿瘤细胞及正常细胞的DNA,进行外显子基因组测序(Whole-exomesequencing,WES)找出肿瘤细胞发生的基因突变。提取患者肿瘤细胞的RNA,进行RNA测序(RNA-Seq)确认这些突变的基因确实在肿瘤细胞中有所表达。那些将肿瘤抗原安插在APC细胞表面的分子,统称为MHC,而在人类中有其特定的名称HLA。提取患者正常组织的DNA,进行HLA测序,明确患者自身的HLA类型。
明确了患者肿瘤细胞发生的基因突变(根据突变后的基因序列可以推出其肽段产物)及其HLA之后,接力棒就交到了计算生物学手中,根据突变后的肽段与患者的HLA分子之间的结合能力,筛选出结合能力最强的数种肽段作为neoantigens,联合佐剂一起回输给患者。
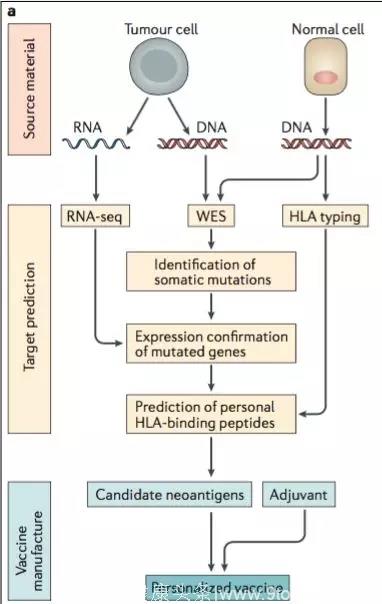
▲图7:个体化肿瘤疫苗的产生(NatRevImmunol,2017Dec)
2015年,第一个基于肿瘤特异性抗原的个体化疫苗治疗在三名黑色素瘤患者中展开(NCT00683670),将患者自身HLA分子结合能力最强的肽段与抗原呈递细胞树突细胞共同培养后回输给患者,该研究表明疫苗有效激发了患者自身的免疫反应,但是获得的临床数据有限。
2017年两项关于肿瘤特异性抗原的个体化疫苗用于黑色素瘤治疗的研究结果新鲜出炉,成果喜人。
第一项研究(NCT01970358)在六位黑色素瘤患者中进行,将20种患者自身肿瘤特异性抗原多肽与佐剂poly-ICLC一起皮下输注。四位stageIII黑色素瘤患者接受疫苗治疗后32个月未见肿瘤复发(tumor-free)。两名stageIV黑色素瘤患者虽然在接受疫苗后仍发生肿瘤进展,但是在接受PD1抑制剂后出现了完全的肿瘤消退(completetumorregression)。
另外一项研究(NCT02035956)在13名黑色素瘤患者中进行,患者首先接受针对肿瘤相关抗原NY-ESO-1或者tyrosinase的疫苗,然后接受由10种肿瘤特异性抗原的mRNA。接受疫苗时,8名患者无疾病表现,在接受疫苗后的12-23个月内未见肿瘤发生;接受疫苗时5名患者已出现肿瘤转移,其中2名患者对疫苗治疗产生客观反应(objectiveresponse),1名同时接受PD1抑制剂的患者出现完全反应(completeresponse)。
联合治疗
免疫检查点抑制剂和CAR-T疗法直接强化免疫大将T细胞的识别杀伤能力,而肿瘤疫苗更接近自然免疫过程,靠输入肿瘤抗原、佐剂激活人体的APC细胞,再由APC细胞去激活T细胞,因此反应周期长而且激活能力有限。肿瘤细胞及其周围细胞建立起来的抑制性微环境也限制了疫苗的作用。
Prostvac临床试验的首席研究员JamesLGulley称其“坚信肿瘤疫苗自身(monotherapy)不会是最优的治疗方法。基于肿瘤微环境的差异,将疫苗与PD-(L)1抑制剂、IL-15、TGFb抑制剂、IDO抑制剂联合应用或是解决之道。”
虽然BavarianNoridc公司的肿瘤疫苗产品Prostvac作为单独疗法治疗前列腺癌的III期临床试验刚刚宣告失败,其团队已经悄然展开将Prostvac与免疫疗法联合应用的临床试验。
在一项研究Prostvac与ipilimumab联用治疗转移性、去势耐受型前列腺癌的I期临床试验中,接受10mg/kgipilimumab治疗的患者总体生存期为26.6个月,联合Prostvac组的总体生存期为37.2个月,明显提高了治疗效果。2017年4月BavarianNoridc公司宣布开展将Prostvac与Bristol-MyersSquibb公司的ipilimumab、nivolumab联合应用的II期临床试验。此外,JohnsHopkinsUniversity也开始了将肿瘤疫苗GVAX与PD1抑制剂联用的试验。
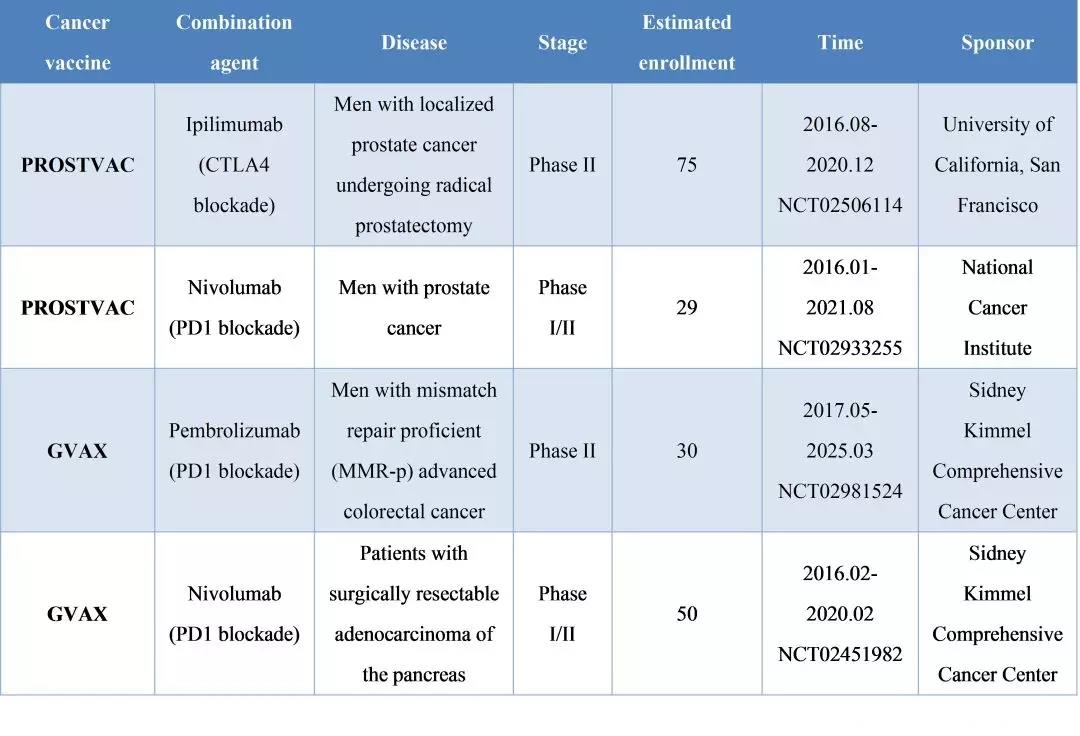
▲图8:肿瘤疫苗与免疫检查点抑制剂联合应用的临床试验
结语
肿瘤疫苗研究黑暗并且混乱的“中世纪”已经过去,理论研究的深入、技术的突破性进展、持续上线的针对抑制性肿瘤微环境的疗法,都将为新时期肿瘤疫苗研究插上翅膀。肿瘤疫苗研究的新时代已经开始,那投资的春天还远吗?
【作者简介】
Echo 徐:北京大学药学院本硕,现约翰霍普金斯大学在读博士,研究免疫代谢、肿瘤免疫相关课题。
参考文献:
1.Towardspersonalized,tumor-specifictherapeuticvaccinesforcancer.ZhutingHu,PatrickA.Ott,CatherineJ.Wu.NatureReviewsImmunology.11Dec2017publishedonline.
2.Overviewofcancervaccines.AlexKudrin.HumanVaccines&Immunotherapeutics.2012,8(9):1335-1351.
3.Cancervaccines.LisaH.Butterfield.BMJ2015;350.
4.Therapeuticvaccinesforcancer:anoverviewofclinicaltrials.NatureReviewsClinicalOncology,2014,11(9):509-524.
5.CancerVaccineTherapies:FailuresandFutureOpportunities.MichaelD.Becker,JanetDally,JefferyMartini.
6.Callingcancer’sbluffwithneoantigenvaccines.https://www.nature.com/articles/d41586-017-08706-3
(原标题—投资肿瘤疫苗的春天到来了吗?)