干细胞-材料复合物:低细胞剂量治疗骨性关节炎
近年来,生物材料被广泛应用于递送细胞或药物,与2D细胞培养相比,3D细胞培养具有更广泛的细胞-细胞和细胞-基质相互作用,使细胞处于最佳的生长状态,更利于发挥治疗作用。
2021年2月25日,华中科技大学同济医学院附属协和医院骨科研究团队在期刊Chemical Engineering Journal(IF:10.652)上发表了题为Implanted 3D gelatin microcryogel enables low-dose cell therapy for osteoarthritis by preserving the viability and function of umbilical cord MSCs 的研究论文。

本项研究构建了一种复合物UCMSC-GM,由脐带间充质干细胞(UC-MSCs)和明胶微凝胶(gelatin microcryogel, GM)组成。研究证明:GM可提供能提高细胞活性、分泌功能以及对抗异常力学载荷能力的3D培养环境。经GM培养并递送植入的UC-MSCs在体内保留时间更长,可持续分泌生长因子,从而促进软骨修复和调节滑膜炎症,达到10倍剂量单纯细胞治疗的效果,为骨关节炎低细胞剂量治疗提供了新思路。
该团队前期研究显示,UC-MSCs能够减轻软骨表层细胞损伤,并抑制巨噬细胞介导的滑膜炎症,且三次给药的疗效优于单次[1]。基于前期研究成果,本研究进一步探讨材料-细胞复合物降低细胞治疗剂量的可行性。

本研究首先运用微阵列芯片,高效、快速制备出明胶微凝胶材料,逐步优化其力学强度、孔径、降解速度等性质,进一步探索了不同的细胞种植浓度和体外培养时间对UC-MSCs在材料上的增殖效率影响,从而筛选出UCMSC-GM较为高效的构建条件。
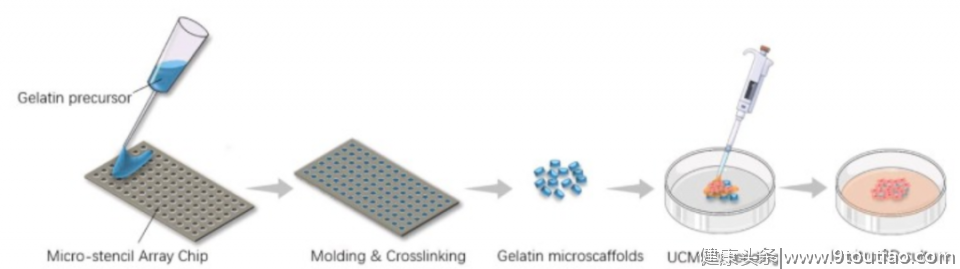
图:明胶微凝胶材料的构建
功能学研究发现:相比较于2D培养的UC-MSCs,GM提供的3D细胞培养环境能够促进干细胞释放EGF和TGF-α,从而促进软骨细胞的生长。这可能是由于TGF-α转换酶(一种调控EGFR配体蛋白成熟和释的重要金属蛋白酶)表达上调引起。

共培养实验发现,相比较于平面培养的UCMSCs,UCMSC-GM更能促进软骨细胞的增殖(Ki67),抑制其凋亡(TUNEL),促进其合成代谢(Col-2,Sox-9)并抑制其分解代谢(MMP-13,ADAMTS-5)的表达,而EGFR的抑制剂吉非替尼(Gefitinib)则能阻断这一作用,进一步证明了UCMSC-GM通过调控EGFR信号通路调控软骨细胞代谢状态的功能。
另外,GM能够促进所搭载细胞的增殖,抑制其凋亡。由于力学环境对干细胞功能具有重要调控作用,研究者在体外模拟生理和病理条件下人膝关节腔内压力环境,并发现:单纯的细胞悬液在异常压力条件下活性及功能均明显减退,而在UCMSC-GM中的干细胞活性及功能减退不明显。这说明:GM能在压力环境下有效保护细胞活性及分泌生长因子的功能,为提升干细胞在OA患者异常关节腔压力下存活并发挥治疗作用提供基础。
为了探究干细胞植入关节后的命运转归,研究者应用小动物活体成像(Luciferase)示踪技术发现,相比较于小鼠关节腔注射的UC-MSCs悬液,植入的UCMSC-GM在体内保留的时间更久,这保证了细胞使用效率的提高。传统观念认为,移植的干细胞在组织缺损处定植生长、分化为损伤组织,是其发挥再生作用的主要机制。
本研究使用绿色荧光蛋白(GFP)转染的UC-MSCs荧光定位示踪技术,发现移植入小鼠关节腔的UC-MSCs主要定植于滑膜、半月板及软骨下骨,极少量分布在软骨组织,提示干细胞修复软骨损伤主要为旁分泌作用,如分泌细胞因子增强内源性细胞修复及抑制炎症反应。
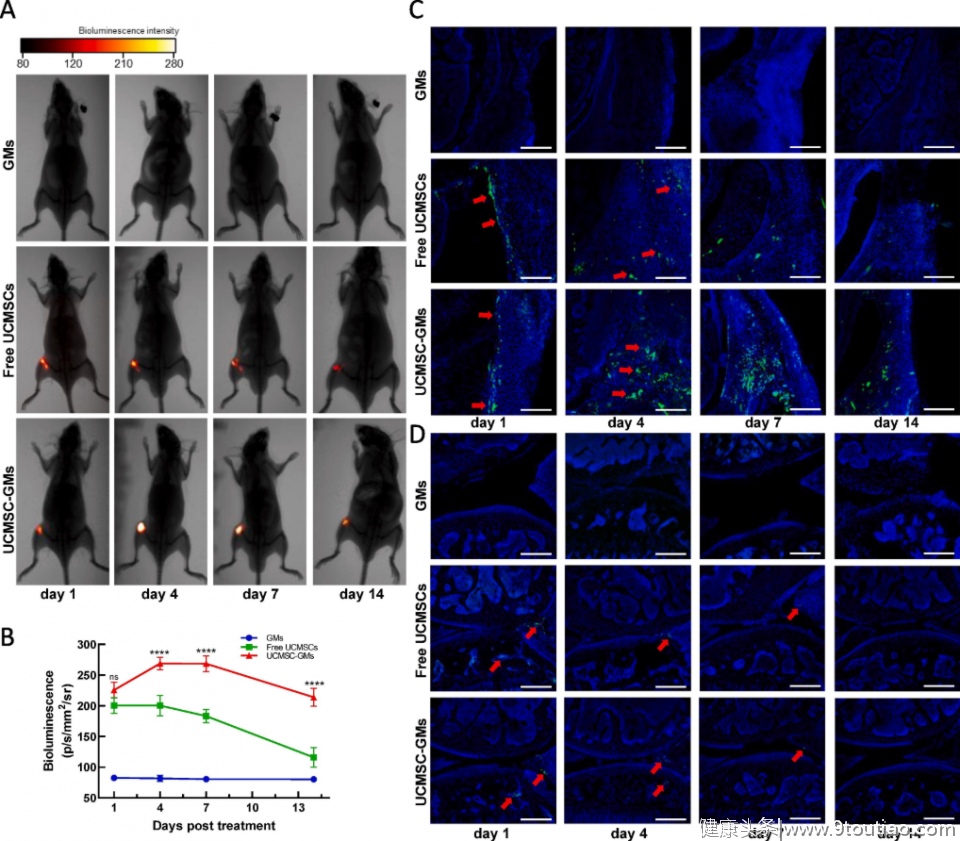
图:经GFP转染的UC-MSCs和UCMSC-GM体内定位
为明确UCMSC-GM治疗OA效果上的优势,本研究使用内侧半月板胫骨韧带失稳术(Destablization of medial meniscus,DMM)手术模型诱导小鼠OA表型,然后关节腔内分别植入UC-MSCs悬液和UCMSC-GMs。组织学结果表明,相比较于UC-MSC细胞悬液,UCMSC-GM更能促进OA小鼠的软骨修复,促进软骨组织合成代谢(Col-2),抑制软骨分解代谢(ADAMTS-5,MMP13)的表达。
另外,关节疼痛是影响OA患者生活质量最主要的症状,也是OA患者就医最主要的因素。研究表明滑膜炎症是OA疼痛产生的重要原因。因此,本研究比较了UC-MSCs和UCMSC-GM对滑膜炎的治疗效果,包括抑制滑膜组织炎症细胞的浸润(CD68)和炎症因子(IL-1β,TNFα,CCL-3)的表达,最终能够缓解疼痛。

综上所述,本研究明确了GM应用的最佳条件,探讨了GM对所搭载细胞活性和细胞因子分泌功能的促进作用。GM增强了UC-MSCs在体内的定植时间,从而显著提升了UC-MSCs修复软骨、抑制滑膜炎症和缓解关节疼痛的治疗效率,并且发现移植的UC-MSCs主要定植于滑膜,提示了干细胞治疗OA的新机制。
基于GM对UC-MSCs的综合作用,低细胞剂量治疗OA成为可能,并为生物材料辅助干细胞疗法在治疗OA的临床应用提供了理论依据。基于本研究基础,团队已着手开展干细胞治疗膝关节OA的 II 期临床试验。(中国临床试验注册中心,注册号:ChiCTR2000039017)
据悉,研究团队(PI:田洪涛)一直从事膝关节骨性关节炎阶梯治疗系列研究,包括干细胞治疗OA的关键技术(国家卫生健康委员会干细胞临床研究项目一项,武汉市3551人才项目一项);膝关节炎保膝治疗策略及关键技术;关节置换日间手术疗效及卫生经济学的临床研究等。
文献链接:
参考文献:
[1]https://www.sciencedirect.com/science/article/pii/S2214031X20300371?via%3Dihub
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])