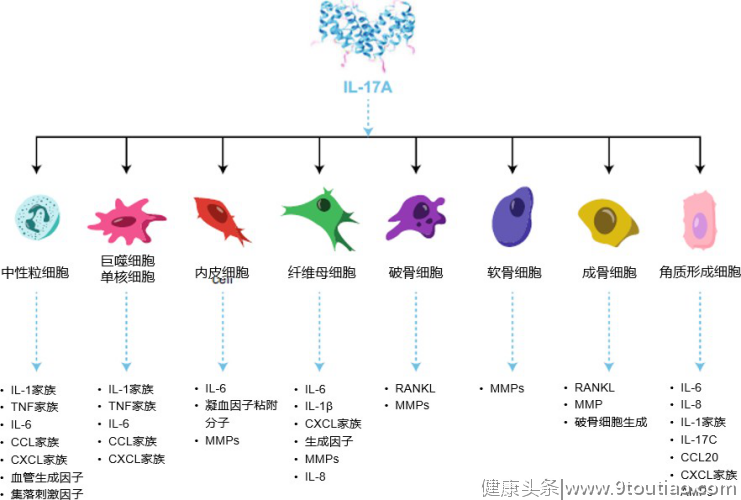
“三头六臂”的IL-17A,如何发挥其多样性生物学功能?
*仅供医学专业人士阅读参考

银屑病(PsO)PsO是以角质形成细胞增殖以及免疫细胞积累为特征的慢性炎症性皮肤病。在PsO患者中,IL-17的促炎和创伤愈合双重作用被长期激活和放大,引起角质形成细胞的致病性增生和皮肤炎症[6]。
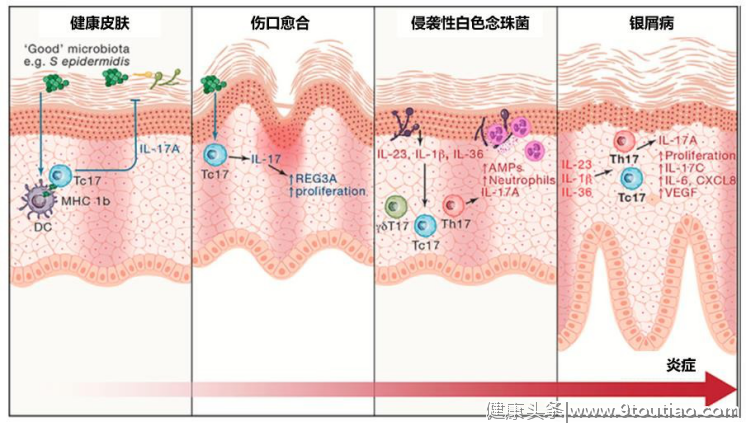
图2:IL-17在皮肤的功能
强直性脊柱炎(AS)AS是一种以累及脊柱和/或骶髂关节为主要特征的慢性炎症性疾病。与类风湿关节炎(RA)和银屑病关节炎(PsA)中的骨破坏不同,AS的特征性病理表现为新骨形成[5]。IL-17A被证明参与AS发生发展的多个病理过程中,如慢性炎症、新骨形成、疼痛发生等[7,10-12]。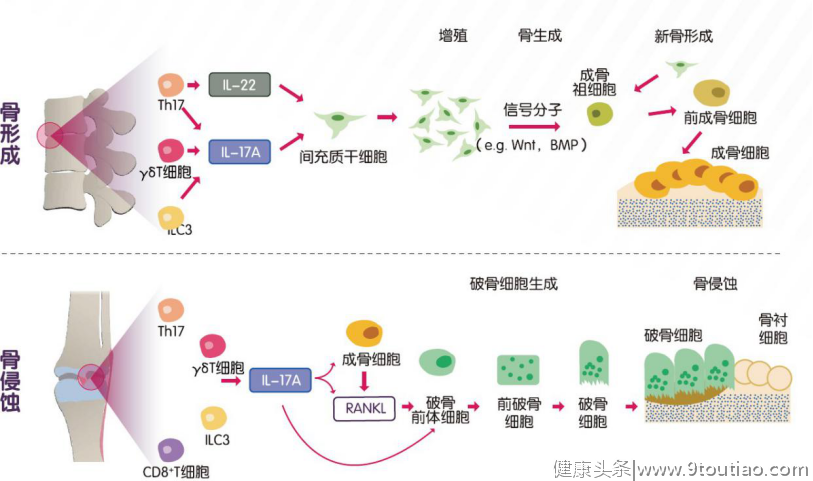
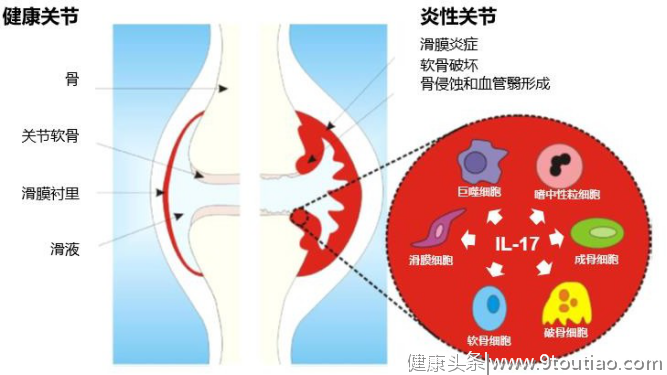
RARA以滑膜炎、骨和软骨破坏为特征,过度的骨破坏及骨修复缺陷导致大量关节破坏。研究发现,在RA患者的血清和滑膜液中IL-17A[5,8-9]表达水平升高,并与疾病活动性相关。提示其可能对骨丢失有作用。
除了以上提及的疾病,其他与IL-17通路相关的疾病还包括哮喘、慢性阻塞性肺疾病(COPD)、动脉粥样硬化等。
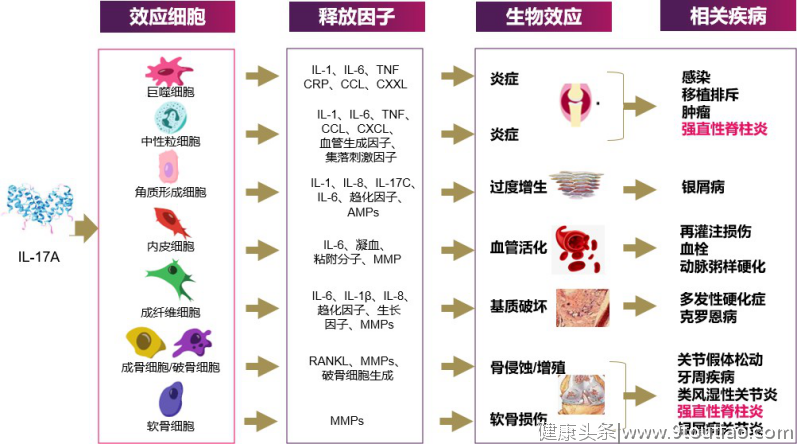
IL-17A靶向药物发展进行时,期待在更多疾病领域大放异彩
尽管越来越多的疾病被发现与IL-17A相关,但这种关联是否能在疾病进展过程中发挥关键作用?我们能否通过靶向IL-17A的方法来治疗疾病呢?
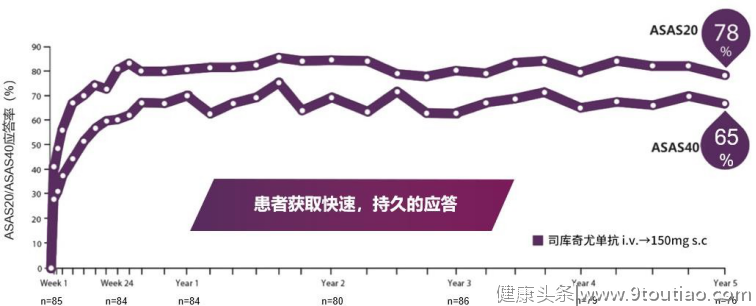
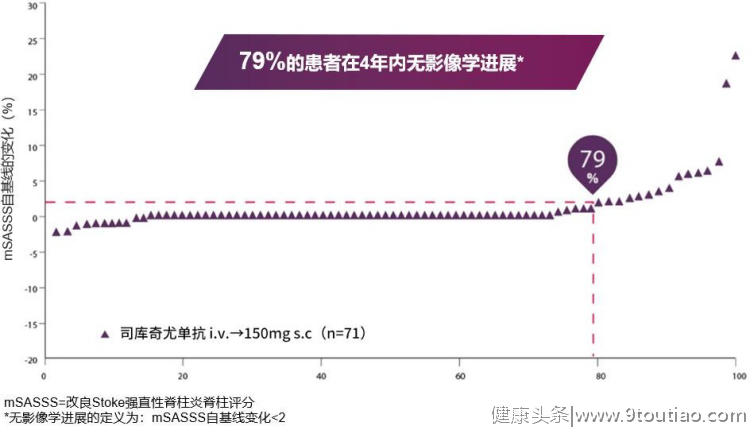
靶向IL-17A的治疗方案在其他疾病领域的疗效作用还在不断地探索中。它们在临床试验中展现的疗效进一步佐证了以往的理论研究,即证实IL-17A在疾病发病机制中的关键作用。未来,我们仍需要更多更深入的研究来确定IL-17A在疾病中的确切作用并积累广泛的临床应用经验,以实现更精准、更个性化的治疗。
4小结IL-17A是一种具有广泛生物学功能的细胞因子,作用于下游多种细胞、介导不同的生理过程并产生相应的生物学效应。已有研究发现,越来越多疾病的发病机制与IL-17A相关联,而IL-17A抑制剂在PsO、PsA、AS等领域疗效显著,大展风采,证明了其在疾病治疗领域的巨大潜力。我们期待未来更多有关IL-17A抑制剂的临床价值的发现和更广泛的临床应用!*司库奇尤单抗目前在国内获批的适应症为中重度斑块状银屑病(PsO)和强直性脊柱炎(AS) 陈国强 教授
陈国强 教授
特殊的2020年,惊险中孕育着希望,不同的风湿免疫疾病类型(如RA、PsA、脊柱关节炎、系统性红斑狼疮/狼疮性肾炎)中,生物/靶向疗法的发展如火如荼,新靶点新药的问世给风湿病的治疗带来了全新的选择,填补临床诊疗的不足。

佛山市第一人民医院院长,党委副书记,临床免疫学主任医师,博士后导师、硕士生导师
- 全国十佳住陪基地负责人,广东省医学领军人才
- 首届佛山名医,国家/广东省自然科学基金、博士后基金评审专家
- 广东省医师协会副会长
- 中国医师协会风湿免疫医师分会常务委员
- 广东省医师协会风湿免疫医师分会主任委员
- 粤港澳大湾区风湿免疫医师联盟副主任
- 广东省医院协会行政管理专委会副主任委员
- 中华风湿病学杂志社编委
- 广东省医学会风湿病学分会常委
- 佛山市医学会风湿病学分会主任委员
- 获佛山市科技进步一等奖、佛山高新技术成就奖和中国医师协会白求恩式好医生提名奖,佛山市创新领军人才”和“佛山市医学领军人物”称号获得者
参考文献:
[1]Miossec P, et al. N Engl J Med. 2009 Aug 27;361(9):888-98. [2]巴罗, 等.华西医学, 2008, 23(2): 401-402.[3]Blauvelt A, et al. Clin Rev Allergy Immunol. 2018 Dec;55(3):379-390.[4]Ebihara S, et al. Autoimmunity. 2015, 48: 259-266.[5]Beringer A, et al.Trends Mol Med. 2016 Mar;22(3):230-241.[6]McGeachy MJ, et al. Immunity. 2019 Apr 16;50(4)892-906.[7]McGonagle DG, et al. Ann Rheum Dis. 2019 Sep;78(9):1167-1178.[8]Koenders MI, et al.Drug Des Devel Ther. 2016 Jun 24;102069-80.[9] 莫颖倩,等. 新医学.2018;49(7)461-467.[10]Moynes DM, et al. Brain Behav Immun. 2014 Oct; 41: 1-9.[11]Sun C,et al. Mol Med Rep. 2017 Jan;15(1):89-96.[12]Lories R, Melones 1B. Nature Medicine 2012-18:1018-19.[13]Kolbinger F, et al. Curr Drug Targets. 2016;17(16):1882-1893.[14]Marwaha AK, et al. Front Immunol. 2012, 3:129.[15]Jiang W, et al. Inflamm Res. 2014;63: 943-50.[16]ClinicalTrials.gov. A study comparing AIN457 to placebo in subjects with a diagnosis of moderate to severe stable plaque psoriasis. https://clinicaltrials.gov/ct2/show/NCT00669916. Accessed 6 September 2019.[17]Novartis Cosentyx positive 16-week PREVENT results advance potential new indication for patients with axial spondyloarthritis [press release]. Basel, Switzerland. 17 September 2019. https://www.novartis.com/news/media-releases/novartis-cosentyx-positive-16-week-prevent-results-avance-potential-new-indication-patients-axial-spondyloarthritis. Accessed 23 April 2020.[18]Novartis Cosentyx gains fourth indication in EU with first-in-class approval in axial spondyloarthritis spectrum.https://www.novartis.com/news/media-releases/novartis-cosentyx-gains-fourth-indication-eu-first-class-approval-axial-spondyloarthritis-spectrum. Accessed 21 December 2020[19]J.Zhang,et al.28th European Academy of Dermatology and Venereology Congress, 9-13 October,2019,Madrid, Spain,#P1600.[20]Baraliakos X et al. RMD Open. 2019;5(2):e001005.[21]Marzo-Ortega H et al. RMD Open. 2017;3(2): e000592.[22]Braun J, et al. Ann Rheum Dis. 2017 Jun;76(6):1070-1077.[23]Braun J, et al. Rheumatology (Oxford). 2019;58(5):859-868. [24] Hannah A. Blair. Drugs. 2019; 79(4) 433–443.