基础疾病多、免疫力低下……高龄类风湿关节炎的治疗该如何优化?

类风湿关节炎(RA)是成人最常见的一种自身免疫性疾病。随着人口老龄化的到来,RA的平均年龄与老年RA的患者数在持续增加。有研究表明,60岁以上的人群中,慢性炎症性风湿性疾病的患者比例在逐渐增加,其中RA患者占30%[1]。与年轻RA患者不同,高龄RA患者的特点主要表现为:起病通常较急,男女比例差异不明显;晨僵多见且持续时间较长;常伴骨质疏松;还可伴有发热或类风湿结节;常合并冠心病、糖尿病、高血压及脑梗死等多种慢性疾病。
关于RA的治疗,以往的临床和研究结果表明,传统药物不能满足所有RA患者治疗需求,且不良反应常见。而高龄RA患者发病特点与年轻患者存在一些差异,亟需疗效佳、安全性可靠的药物。
“医学界”特邀浙江大学医学院附属第一医院风湿免疫科林进教授为我们带来高龄RA患者的优化治疗方案,让我们一起来听听林进教授的真知灼见吧。
高龄RA患者用药更应重视疗效林进教授介绍道:“临床医生在进行药物选择时,除了需要考虑患者的基础状况(比如高龄),更需要重视药物的疗效。目前RA治疗已进入生物时代,主要的生物制剂有肿瘤坏死因子α抑制剂(TNF-α抑制剂)、选择性T细胞共刺激免疫调节剂阿巴西普、白细胞介素-6抑制剂、新型生物制剂如JAK酶抑制剂等。其中以TNF-α抑制剂最常用,但根据目前的研究显示,其用于高龄RA患者的疗效存在矛盾性。”
Filippini等的一项观察性研究[2]和Fleischmann等发表的综述[3]均表明,使用TNF-α抑制剂的年轻RA患者和老年RA患者在EULAR应答、缓解率、影像学进程上没有显著差别。
然而,瑞典学者Stéphane等的一项基于RA人群的纵向研究显示,在年龄>75岁使用TNF-α抑制剂的RA患者中,尽管疾病活动有改善,但功能障碍未出现明显改变[4]。
该研究随访了1997年1月-2005年11月间使用TNF-α抑制剂的患者,采用RA患者病情评价(DAS28评分)分析药物的有效性以及健康评估问卷(HAQ)评估功能障碍。
研究结果显示,1571例使用TNF-α抑制剂的RA患者中,有344例在治疗开始前年龄≥65岁。年轻RA患者和老年RA患者(≥65 岁)的2年DAS28评分平均变化相同。但是,与年轻RA患者(-0.1)相比,老年RA患者(-0.02)HAQ评分改善明显减少(图1),随后的分析揭示,得出此结果最主要的原因是患者年龄>75岁(图2)。
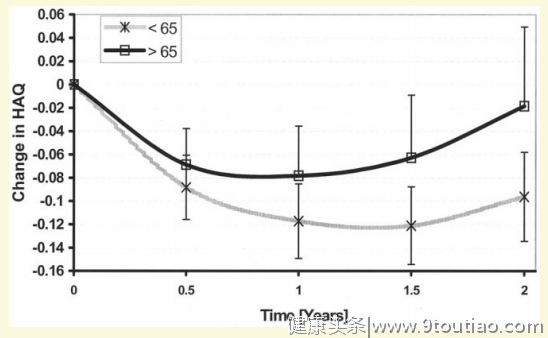
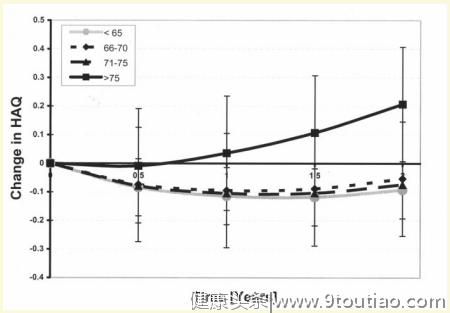
以上研究表明,目前TNF-α抑制剂用于高龄RA患者的疗效尚无统一定论。一方面需要进一步研究TNF-α抑制剂对高龄RA患者的疗效,以得到更可靠的结论。另一方面,临床亟需更多满足高龄RA患者治疗的药物。
随着自身免疫疾病领域的深入研究与发展,越来越多的生物与靶向药物相继问世,也为高龄患者们带来了更多选择。
林进教授补充说:“阿巴西普是2020年国内新上市的生物制剂。它是共刺激免疫调节剂,抑制免疫细胞过度活化,同时减少炎症反应,能有效治疗RA。且研究证实了其在高龄患者中的疗效与安全性。”
Sekiguchi等[5]进行了一项ABROAD研究, 该研究纳入148名老年患者(>65岁)和129名年轻患者(<65岁),患者分别在43家医院接受阿巴西普治疗,采用DAS28评分与C反应蛋白(DAS28-CRP)对患者进行为期48周的疗效评估。
研究结果显示,在24周和48周,老年RA患者DAS28评分缓解35.1%、36.5%。年轻RA患者DAS28评分缓解34.9%、43.4%。老年患者和年轻患者DAS28评分缓解无显著差异性(图3)。
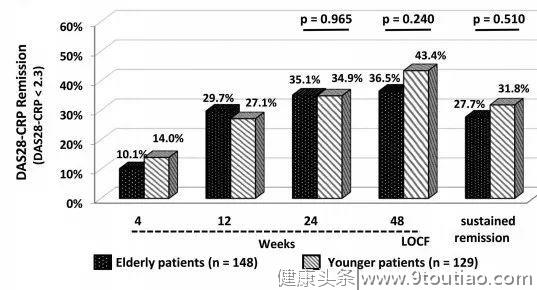
图3:年轻RA患者和老年RA患者DAS28评分对比
这项研究表明,阿巴西普在老年患者和年轻患者中具有相似的疗效。
“除此之外,日本的一项多中心真实世界研究将RA患者分成3组:>72岁RA组、62-72岁RA组和<62岁RA组,比较DAS28-CRP评分和EULAR应答率。研究发现,三组间所有DAS28-CRP评分和EULAR应答率无显著差异[6]。2020年EULAR大会上发表的研究数据亦显示,阿巴西普治疗RA具有显著疗效(尤其是老年患者)[7]。”林进教授补充。
不良反应少、无特殊药物相互作用是王道“对高龄RA患者的药物选择另一点必须考虑其安全性。高龄患者可能面临更高的不良反应风险,大多数高龄RA患者由于生理功能明显减退,药物代谢能力较年轻人差,药物易在体内蓄积,增加毒副作用。且高龄患者心脑血管等基础疾病较多。所以,对高龄患者而言,保证药物的安全性,能够提高药物依从性,且能够改善患者生活质量。”林进教授说。
以往的研究表明,传统药物(非甾体类抗炎药、激素类药物等)会造成较多不良反应,比如心血管疾病、感染、骨质疏松、消化道出血和肾衰竭等。目前国内常用的生物制剂TNF-α抑制剂亦存在感染[8]、肿瘤[9]、结核复发[10]等不良反应风险。
一项回顾性队列研究表明,TNF-α抑制剂相比阿巴西普,发生急性心肌梗死(AMI)的风险更高[11]。
该研究纳入47193名RA患者,平均年龄64岁,85%为女性。比较AMI发病率和冠脉血管重建/AMI的混合结果。用多变量调整Cox回归模型来检验生物类型与生物多样性之间的关系。
结果显示,相较于阿巴西普,在使用TNF-α抑制剂后AMI的发病率明显增加[调整危险率(aHR) 1.28;95% CI 1.04 -1.56](图4),包括依那西普(aHR 1.33;95% CI 1.01 -1.76)与英夫利西单抗(aHR 1.30;95% CI 1.03-1.64)(图5)。
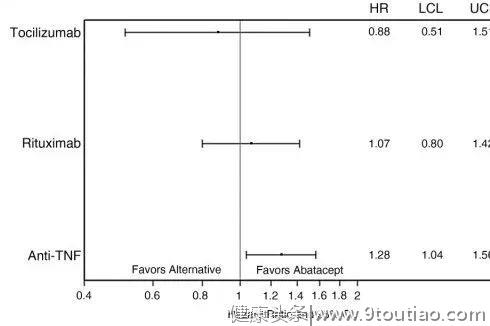
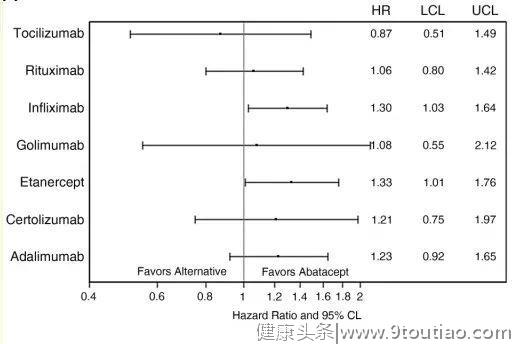
以上研究结果提示,阿巴西普在具有心血管风险的患者中可能具有更大的安全性优势。
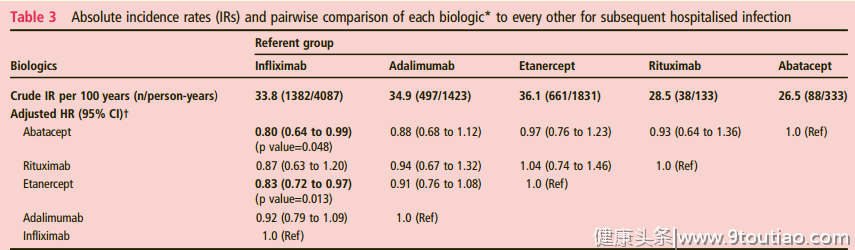
2015年发表在《Ann Rheum Dis》的一项研究[12],纳入10183名使用TNF-α抑制剂期间经历过住院感染的RA患者,其中有333人使用阿巴西普、133人使用利妥昔单抗、1797人使用依那西普、1405人使用阿达木单抗、4139人使用英夫利西单抗。随后住院感染发病率为27.1-34.6/100人。
经过多变量调整后发现,阿巴西普(HR: 0.80;95% CI 0.64-0.99)相较于依那西普、利妥昔单抗、阿达木单抗、英夫利西单抗,发生继发感染的风险最低。(图6)
美国10年队列研究通过倾向性得分匹配方法,评估了使用阿巴西普与TNF-α抑制剂的RA患者因感染住院的相对风险,研究主要终点表明,阿巴西普因感染住院的风险低于TNF-α抑制剂[13]。(图7)
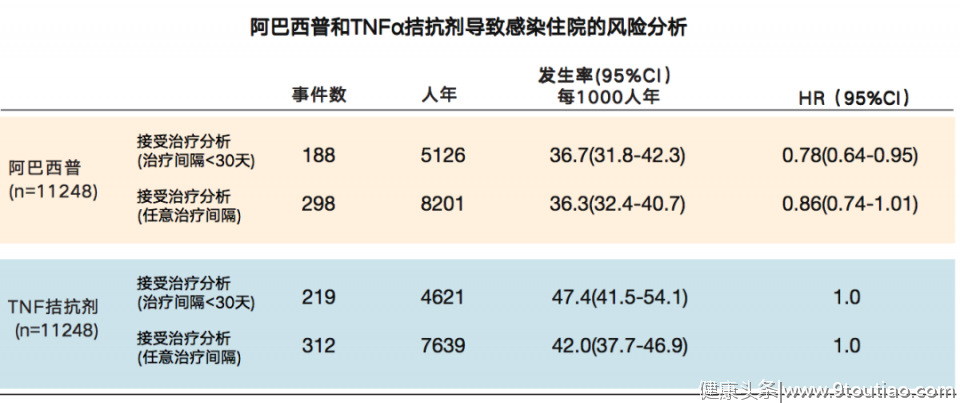
图7:美国10年大数据对比分析阿巴西普与TNF-α抑制剂因感染住院的风险
IMI101-100研究纳入219名RA患者进入长期治疗,其中有114名患者接受阿巴西普和甲氨蝶呤(MTX)的治疗。经过7年随访发现,相比1年双盲期,阿巴西普长期治疗期间的安全性事件总体发生率没有增加,包括严重感染、恶性肿瘤和自身免疫事件等,且未见结核病例报道[14]。(表1)
表1:IMI101-100研究中安全性事件发生率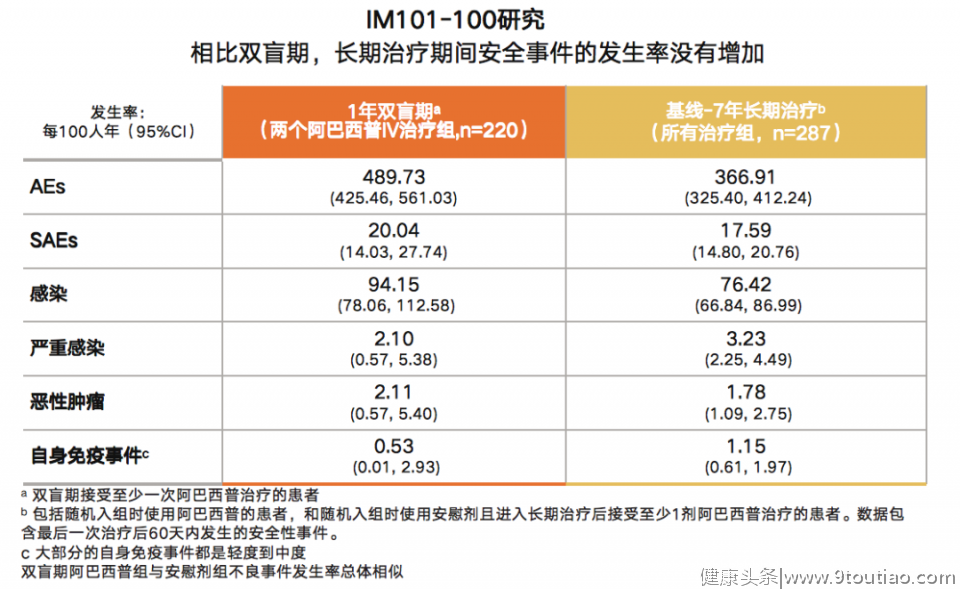
ATTAIN研究纳入317名RA患者进入长期治疗(218名患者双盲期接受阿巴西普,99名双盲期接受安慰剂),150名患者最终完成试验。经过5年随访发现,相比0.5年双盲期,阿巴西普长期治疗期间严重感染、恶性肿瘤和自身免疫事件等的总体发生率没有增加,且未见结核病例报道[15]。(表2)
表2:ATTAIN研究中安全性事件发生率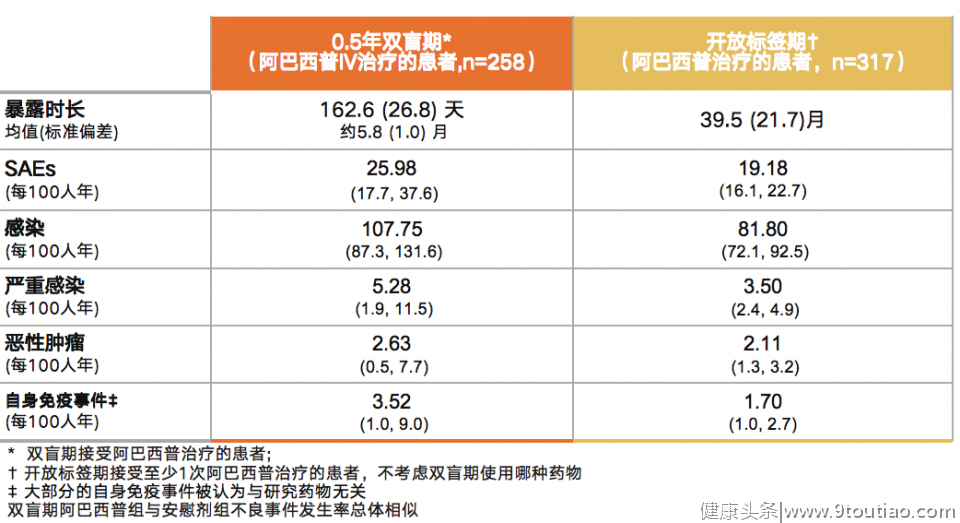
除了感染风险低和无结核病例发生。一项安慰剂对照的临床试验中(1955例患者应用阿巴西普治疗,中位治疗时间12个月),阿巴西普和安慰剂组的恶性肿瘤总体发生率相似(分别为1.3%和1.1%)。另有一项在72名携带乙肝病毒的RA患者中进行的试验显示,静脉注射阿巴西普治疗,随访24个月后,未见患者乙肝病毒复发报道[16]。
林进教授表示,“高龄RA患者在安全性方面的考虑,除了不良反应,还应考虑药物的相互作用。高龄患者常存在合并症/合并用药情况。阿巴西普没有特殊的药物相互作用。在不改变剂量的情况下,可以与止痛药或非甾体抗炎药等多种药物联合应用。”
最后,林进教授说,“国外临床研究数据证实了阿巴西普在高龄患者中的疗效与安全性,期待它在中国上市后能给RA患者带来更多的治疗希望。但由于目前国内尚无专门针对高龄RA患者使用阿巴西普的临床研究,临床医师应在今后用药中多关注此方面信息,以得到更可靠的数据支持。”

林进教授
浙江大学医学院附属第一医院风湿免疫科主任浙江省医学会风湿病学分会主任委员浙江省医师协会风湿免疫科医师分会侯任会长中华医学会风湿病学分会常委中国医师协会风湿免疫科医师分会常委浙江省医学会内科学分会副主任委员浙江省医师协会内科学医师分会副会长兼总干事参考文献:
[1] Lahaye C, Tatar Z, Dubost J-J, Soubrier M. Overview of biologic treatments in the elderly[J]. Jt Bone Spine, 2015, 82(3):154–60.
[2] Filippini M, Bazzani C, Favalli EG, Marchesoni A, Atzeni F, Sarzi-Puttini P, et al. Efficacy and safety of anti-tumour necrosis factor in elderly patients with rheumatoid arthritis: an observational study[J]. Clin Rev Allergy Immunol, 2010, 38(2–3):90–6.[3] Fleischmann R, Iqbal I. Risk: benefit profile of etanercept in elderly patients with rheumatoid arthritis, ankylosing spondylitis or psoriatic arthritis[J]. Drugs Aging, 2007, 24(3):239–54.[4] Stéphane Genevay, Axel Finckh, Adrian Ciurea,et al. Tolerance and effectiveness of anti–tumor necrosis factor therapies in elderly patients with rheumatoid arthritis: A population-based cohort study[J]. Arthritis Care & Research, 2007.[5] Sekiguchi M, Fujii T, Matsui K, Murakami K, Morita S, Ohmura K, et al. Differences in predictive factors for sustained clinical remission with abatacept between younger and elderly patients with biologic-naive rheumatoid arthritis: results from the ABROAD Study[J]. J Rheumatol, 2016, 43(11):197[6] Takahashi N, Kojima T, Asai S, Watanabe T, Matsumoto T, AsaiN, Sobue Y, Ishiguro N. Being elderly is not a predictive factor of discontinuation of abatacept due to adverse events in rheumatoid arthritis patients with concomitant methotrexate: a retrospective observational study based on data from a Japanese multicenter registry study [abstract]. Arthritis Rheumatol, 2017, 69,4–83.[7]EULAR SAT0116 (2020).http://scientific.sparx-ip.net/archiveeular/?searchfor=SAT0116&c=a&view=1&item=2020SAT0116[8] KOMANO Y, TANAKA M, NANKI T, et al. Incidence and risk factors for serious infection in patients with rheumatoid arthritis treated with tumor necrosis factor inhibitors: a report from the registry of Japanese rheumatoid arthritis patients for longterm safety[J].J Rheumatol,2011,38( 7) : 1258-1264[9] MARIETTE X,MATUCCI-CERINIC M, PAVELKAK, et al. Malignancies associated with tumour necrosis factor inhibitors in registries and prospective observational studies: a systematic review and meta -analysis[J].Ann Rheum Dis, 2011, 70( 11) : 1895-1904[10] NAVARRA S V,TANG B,LU L,et al.Risk of tuberculosis with anti-tumor necrosis factor-α therapy: substantially higher number of patients at risk in Asia[J]. Int J Rheum Dis,2014,17( 3) : 291-298.[11] Zhang J, Xie F, Yun H, Chen L, Muntner P, Levitan EB, et al. Comparative effects of biologics on cardiovascular risk among older patients with rheumatoid arthritis[J]. Ann Rheum Dis, 2016, 75(10):1813–8[12] Yun H, Xie F, Delzell E, Chen L, Levitan EB, Lewis JD, et al. Risk of hospitalised infection in rheumatoid arthritis patients receiving biologics following a previous infection while on treatment with anti-TNF therapy[J]. Ann Rheum Dis, 2015, 74(6):1065–71.[13] Chen SK, Liao KP, Liu J, et al. Risk of Hospitalized Infection and Initiation of Abatacept Versus Tumor Necrosis Factor Inhibitors Among Patients With Rheumatoid Arthritis: A Propensity Score-Matched Cohort Study[J]. Arthritis Care Res (Hoboken), 2020, 72(1):9-17. [14] Westhovens R, Kremer JM, Emery P,et al. Long-term safety and efficacy of abatacept in patients with rheumatoid arthritis and an inadequate response to methotrexate: a 7-year extended study.[J]. Clinical & Experimental Rheumatology, 2014, 32(4):553-562.[15] Genovese M C , Schiff M , Luggen M , et al. Longterm Safety and Efficacy of Abatacept Through 5 Years of Treatment in Patients with Rheumatoid Arthritis and an Inadequate Response to Tumor Necrosis Factor Inhibitor Therapy[J]. Journal of Rheumatology, 2012, 39(8):1546-54.[16] Padovan M, et al. Arthritis care & research, 2016, 68(6): 738-743.爱我请给我好看!