艾伯维Rinvoq在比较治疗银屑病关节炎的试验中战胜Humira!
编译丨柯柯
近日,艾伯维宣布了SELECT-PsA 1临床3期试验的积极结果。与安慰剂相比,对一种或多种非生物缓解疾病的抗风湿药(DMARDs)反应不足或不耐受的活动性银屑病关节炎成人患者,两种剂量的RINVOQTM(upadacitinib,乌帕替尼)均达到ACR20反应的主要终点;且与安慰剂相比,RINVOQ在各种终点上也显示出疾病征象和症状的显著改善。
此外,在第12周时,就主要重点ACR20反应而言,30mg剂量RINVOQ的疗效优于阿达木单抗,且与阿达木单抗相比,两种剂量均达到非劣效性。
艾伯维副总裁兼总裁医学博士Michael Severino表示,“这项大型3期研究的结果进一步支持了RINVOQ的潜力。我们期待与世界各地的监管机构共享这些数据,推动该药物在标签扩展应用中纳入包括活动性银屑病成年患者的应用。”
SELECT-PsA 1是一项多中心、随机、双盲、平行组、活性和安慰剂对照临床3期研究,旨在评估RINVOQ与安慰剂、阿达木单抗相比在对至少一种非生物DMARD反应不足的活动性银屑病关节炎成年患者中的安全性和有效性。患者在接受RINVOQ 15 mg或30 mg治疗第24周时随机分配到RINVOQ 15 mg、30 mg、阿达木单抗40 mg或安慰剂组。
主要终点为接受RINVOQ 15 mg或30 mg治疗12周后相对于安慰剂组达到ACR20反应的百分比。次要终点包括在第12周时健康评估问卷残疾指数(HAQ-DI)的基线变化;在第16周时达到银屑病区域严重程度指数评分改善75%(PASI 75)的患者比例;在第24周时达到最低疾病活动(MDA)的患者比例。该试验仍在进行中,评估患者每天两次服用一次RINVOQ 15 mg和30 mg的长期安全性、耐受性和疗效。
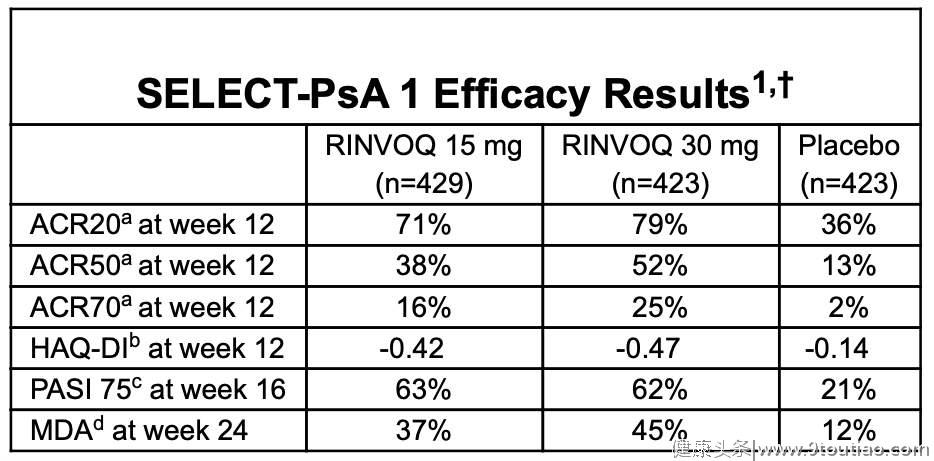
这一阶段公布的结果显示,在第12周时,接受15 mg和30 mg RINVOQ治疗的患者达到ACR20的比例分别为71%和79%,安慰剂组为36%;达到ACR50的比例分别为38%和52%,安慰剂组为13%;达到ACR70的比例分别为16%和25%,安慰剂组为2%。
与阿达木单抗相比,两种剂量RINVOQ的疗效均实现了非劣效性,30 mg组更显示出了优越性。
根据HAQ-DI的测量,接受15 mg和30 mg RINVOQ的患者在第12周的身体机能有较大改善,基线值分别为-0.42和-0.47,均高于安慰剂组的-0.14;在第16周的皮肤症状也有所改善,PASI 75分别为63%和62%,安慰剂组为21%;在第24周的MDA分别为37%和45%,安慰剂组为12%。
格拉斯哥大学感染、免疫和炎症研究所教授Iain McInnes说,SELECT-PsA 1的结果表明,与安慰剂相比,两种剂量的upadacitinib在关节和皮肤症状上均显示出更高的疗效,并且对放射学进展的抑制作用明显。
表 SELECT-PsA 1研究结果
 图片来源:艾伯维官网
图片来源:艾伯维官网根据修改的PsA Sharp/van der Heijde得分变化,治疗24周后,与安慰剂相比,15 mg和30 mg RINVOQ显著患者的抑制放射学进展(RP)。RP常预示患者随后的关节受损将更严重、关节功能更差,影响其身体机能和致残。
RINVOQ的安全性与先前报道的研究结果一致,没有发现新的安全风险。至第24周,15 mg和30 mg RINVOQ组发生严重感染分别为1.2%和2.6%,安慰剂组为0.9%,阿达木单抗组为0.7%。30 mg组有1例静脉血栓栓塞事件,15 mg组没有,阿达木单抗组2例,安慰剂组1例。RINVOQ组均未报告重大心血管不良事件,安慰剂组1例,阿达木单抗组2例。此外,仅安慰剂组有1例死亡,其他三组无死亡病例报道。
RINVOQ是由艾伯维发现和开发的一种选择性、可逆JAK抑制剂,2019年8月,该药获得美国FDA批准,用于治疗对甲氨蝶呤反应不足或不耐受的中度至重度活动性类风湿关节炎成年患者,用于银屑病性关节炎、轴向性脊椎关节炎、克罗恩病、特应性皮炎等多种免疫介导的炎性疾病的临床3期试验中正在进行中。
此外,艾伯维希望Rinvoq与旗下另一重磅抗炎药、IL-23拮抗剂Skyrizi合作。今年1月J.P.摩根医疗健康大会上,艾伯维首席执行官Richard Gonzalez认为,Rinvoq和Skyrizi的合计年销售额最高可达200亿美元,与Humira最好的一年大致相当。
参考来源:AbbVie's Rinvoq scores Humira-matching trial win in psoriatic arthritis