重度哮喘:下一个抗体药物的必争之地
2017年8月,CFDA正式批准诺华茁乐®(奥马珠单抗)用于治疗中至重度持续性过敏性哮喘,意味着我国的哮喘治疗步入抗体药物时代。
作为哮喘抗体药物的老大哥,奥马珠单抗已经在海外上市14年,2016年为诺华带来近8亿美元的年销售额。据估计,全球约有3.4亿哮喘病人,哮喘药市场约160亿美元并将持续增长。
虽然当下抗体药物只占三席,一个趋势却越来越明显:抗体药在哮喘尤其是重度不可控哮喘治疗中的作用越来越重要,其市场份额也将越来越大。
面对纷繁的免疫系统和哮喘病理,哪些靶点更有可能成为下一个市场争夺者?
哮喘:不能呼吸之痛哮喘是一种呼吸道慢性炎症疾病,发病机制比较复杂,普遍认为是基因和环境因素共同导致。该病的主要特征是呼吸道超敏反应,可逆性气流阻塞,支气管平滑肌痉挛,以及呼吸道炎症,常见的症状包括喘息,呼吸困难,咳嗽,胸闷等。
或许我们能从病人的自述中了解一下哮喘的痛苦:“像鱼离开水”, “像大象踩在胸口上”,“像枕头狠狠捂在脸上”,“咳嗽到不能呼吸”,“每次发作都像和死神打了个照面”……很多病人因为哮喘失去了正常运动和工作的能力,生活质量急转直下。
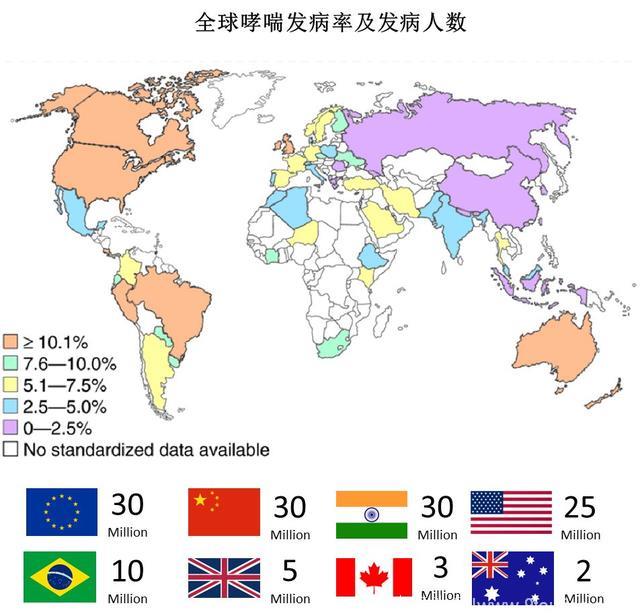
2014全球哮喘报告显示,哮喘的发病率约为4.3%,这意味着全世界有大约3.34亿人患有不同程度的哮喘。预计到2025年,这一数字还将增长1个亿,变成4.34亿。
这一预测也不无道理,如果我们比较一下不同国家哮喘的发病率就会发现,通常发达国家的哮喘发病率会比发展中国家/欠发达国家高很多。
这意味着由于经济条件的制约,在广大发展中国家,有很多病人未能得到有效的诊断和治疗,这其中也包括中国:2013年流病调查显示我国哮喘发病率为1.24%,远低于全球平均水平。
哮喘给社会和个人带来很大的经济负担,据估算,发达经济体每年在哮喘上的花费要占到其医疗总支出的1%到2%, 比结核和艾滋病的花费加起来还要高。
Source: Sears, M.R., Trends in the prevalence of asthma. Chest, 2014. 145(2): p. 219-225.
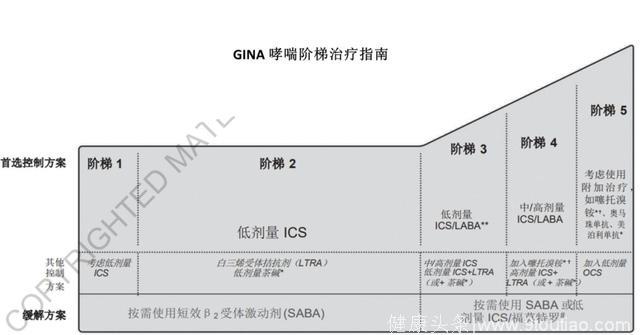
哮喘:200亿美元市场哮喘的治疗一般遵循全球哮喘倡议(Global Initiative for Asthma, GINA)的阶梯治疗指南 (见指南图)。常用的药物包括吸入型/口服型糖皮质激素(ICS/OCS), 白三烯受体拮抗剂 (LTRA),长效β2 受体激动剂(LABA),短效β2 受体激动剂(SABA),长效毒蕈碱受体拮抗剂(LAMA),茶碱等。抗体药物也从2005年开始纳入治疗指南。
Source: 2017 GINA哮喘治疗指南
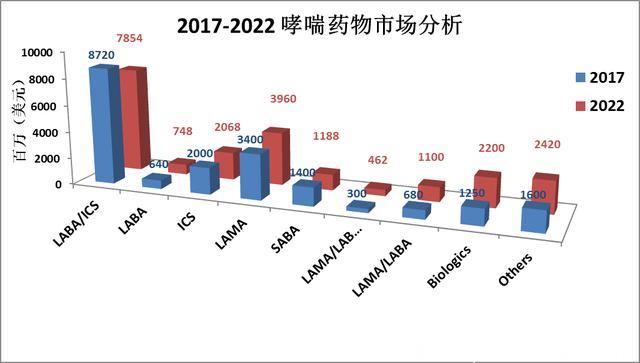
由于庞大的患病人数和长久的病程,哮喘药物一直是呼吸系统用药的大头。2017全球哮喘用药市场估计在200亿美元左右,并将以每年2%的速度增长,于2022年有可能达到220亿美元。
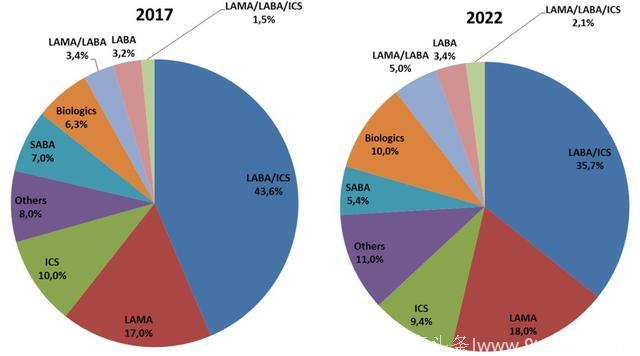
按药物来看,长效β2 受体激动剂+糖皮质激素联用吸入剂(LABA+ICS),或者两者单用类的药物主导着市场,几乎占有一半的份额。考虑到还有一些一天一用的超长效β2 受体激动剂(ultra-LABA)在研发中,未来五年内,这类药物的市场地位会进一步得到巩固。
LAMA占据市场第二的席位(18%)。SABA作为常用的哮喘快速缓解剂,能占到大约6.5%的市场份额。由于LABA+ICS的经典联用面临专利到期等问题,新的联用剂型比如LAMA+LABA, LAMA+LABA+ICS等新组合跑步入场取代经典联用。
一个明显的趋势是抗体药物的迅速崛起,虽然现在全球市场上仅有四支哮喘抗体药物,可以肯定的是这个比例和市场份额会持续快速的增长,5年预计可以达到22亿美元。
Source: personal sources
抗体药物:严重不可控哮喘病人的希望大部分哮喘病人在现有的治疗指南下病情可以得到很好的控制,但是有大约5%到10%患有严重或者不可控哮喘。然而这一小部分病人的医疗支出却能占到整个哮喘治疗支出的60%以上,因为这部分病人的恶化率和住院率比较高,占用比较多的门诊和急诊资源。
具体到个人,严重不可控哮喘病人的花费要高于二型糖尿病、中风、或慢性肺阻病(COPD)。
有以下几个因素导致了现有指南治疗严重哮喘的局限性:
第一, 疗效有限。轻度到中度哮喘病人可以根据指南得到很好的管理,但是严重哮喘病人的死亡率和发病率并没有得到有效的改善。
第二, 不良反应。吸入型药物有这良好的安全记录,口服类的药物更应该引起注意。比如口服糖皮质激素更容易引起系统性的不良反应和潜在发病风险;茶碱的治疗窗又比较窄,耐受性差。
第三, 病人的依从性差。据估计,大约有50%的儿童和30-70%的成人无法严格依从哮喘指南的治疗方案。这其中有多种原因,比如吸入剂的使用方法掌握不当、治疗方案复杂、病人担忧不良反应等。
第四, 存在合并症。很多哮喘病人有肥胖、心血管疾病、过敏、吸烟等合并症,给治疗带来更多的挑战。通常情况下,合并症和哮喘会形成恶性循环。
由于抗体药物直接针对哮喘发病的免疫机制,给很多严重不可控病人带来了希望。为了更好的了解抗体药物的靶点,我们先来了解一下严重哮喘的炎症机制。
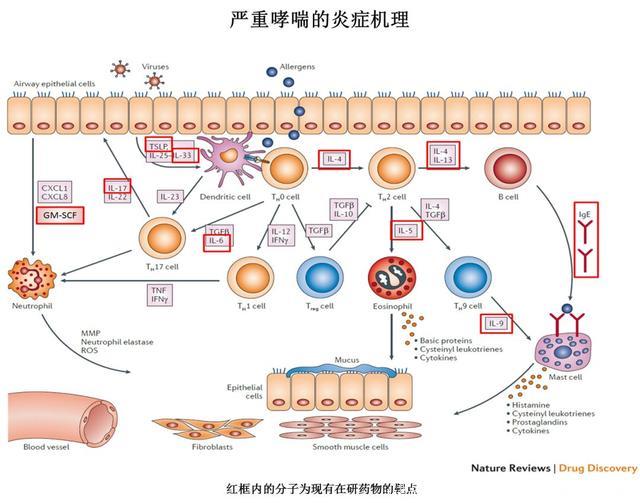
Source: Nature Reviews Drug Discovery 11, 958–972 (2012)
哮喘的炎症反应非常的复杂,涉及到呼吸腔内一系列的免疫细胞和炎症分子。
过敏性哮喘的触发始于呼吸道上皮细胞在接触过敏原后分泌白细胞介素25,33(IL-25, IL-33),以及胸腺基质淋巴细胞生成素(TSLP),从而激活树突状细胞(DC)。
免疫原经过DC的处理呈递给辅助性T细胞(Th0),后者分泌IL-4激活Th2辅助细胞。Th2细胞被激活后释放更多的IL-4和IL-13,从而促进B细胞产生免疫球蛋白E(IgE)。
Th2细胞分泌的IL-4和转化生长因子β(TGFβ),还能激活Th9辅助细胞分泌IL-9,进而促进肥大细胞(mast cells)的生长。
被IgE结合了的肥大细胞可以结合抗原,引起细胞脱粒并释放大量的化学中介物,比如组胺,前列腺素,白三烯等,诱发支气管平滑肌收缩并进一步刺激炎症反应。Th2细胞还能分泌IL-5来保证嗜酸性粒细胞的存活和生长。
此外,Th17辅助型T细胞是非嗜酸性粒细胞哮喘发病中的一个重要角色,它能产生IL-17来募集和扩增中性粒细胞。
机制图中红色方框框出了临床在研抗体药物的靶点,我们将在下面详细讨论。
免疫球蛋白E(IgE)如上所述,IgE在哮喘炎症反应通路上有着举足轻重的作用,尤其对过敏性哮喘的发病。
2003年,诺华的IgE抗体,奥马珠单抗(omalizumab, 商品名Xolair)作为第一个针对哮喘的抗体药物进入市场,标志着哮喘治疗正式步入抗体时代。奥马珠单抗通过中和IgE来抑制免疫细胞的激活,降低T细胞抗原呈递的效率,从而整体降低哮喘病人的免疫反应。
作为哮喘抗体药物的老大哥,奥马珠单抗已经在海外获批14年,2016年为诺华带来近8亿美元的年销售额。2017年8月,CFDA正式批准奥马珠单抗 (中文商品名茁乐®)用于治疗中至重度持续性过敏性哮喘,意味着抗体药物打开了我国哮喘市场的大门。
奥马珠单抗的适应症为成年及青少年(12岁以上)中到重度持续性哮喘病人,且使用吸入型糖皮质激素(ICS)得不到改善的情况下,用作附加药物。临床试验显示其作为高剂量ICS附加药物可以显著降低病人的恶化率,尤其是季节性过敏性哮喘,并可以提高病人的肺功能。
到目前为止,奥马珠单抗已在全球范围内积累了50万病例并且保持着良好的安全性和有效性记录。由于奥马珠单抗已处于其专利夕阳时期,诺华自己以及其他公司也在加紧新的IgE抗体的研发。
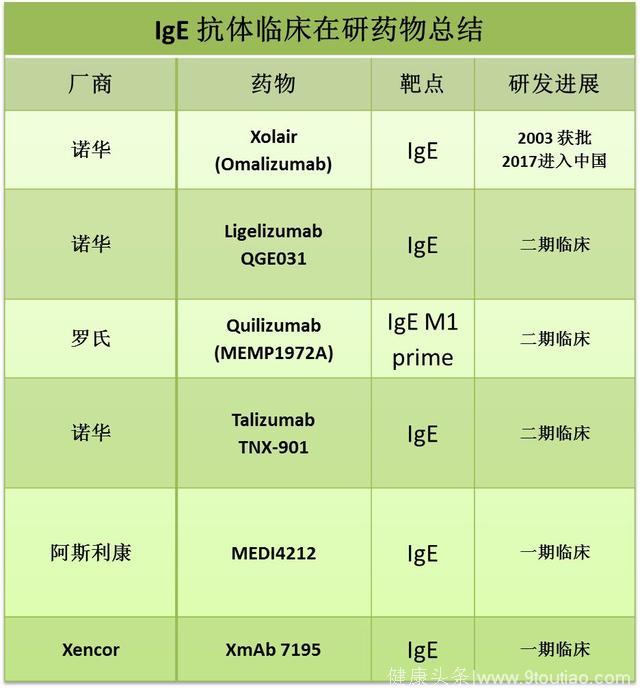
Source: clinical trial database
白细胞介素5(IL-5)IL-5能促进嗜酸性粒细胞的分化和成熟,在嗜酸性粒细胞哮喘发病过程中起着关键作用,因此IL-5一直是哮喘治疗的明星靶点,对于治疗顽固性、糖皮质激素抵抗性哮喘的应用被给予厚望。
目前,针对IL-5的抗体已有两款药物获得批准,分别为2015年获批的葛兰素史克(GSK)的美泊利单抗(mepolizumab,商品名Nucala),以及2016年获批的梯瓦(Teva)的reslizumab(商品名为Cinqair)。美泊利单抗被批准用于成人和青少年(12岁以上),reslizumab只被批准在成年患者中使用。
我们以美泊利单抗的临床试验为例,在嗜酸性粒细胞哮喘病人中(嗜酸性粒细胞计数大于300/微升),美泊利单抗显著降低了病人的恶化率以及口服糖皮质激素的用量,而且病人入组前的嗜酸性粒细胞计数越高,效果越明显。
IL-5结合其受体发挥作用,因此针对IL-5受体(IL-5R)的抗体也被用于治疗哮喘。
今年11月,阿斯利康针对IL-5R的单抗benralizumab (商品名Fasenra)迎来了美国FDA的绿灯通行,用于治疗12岁以上的严重的嗜酸性细胞哮喘,让阿斯利康这一制药巨头也加入到哮喘抗体药物的角逐中。
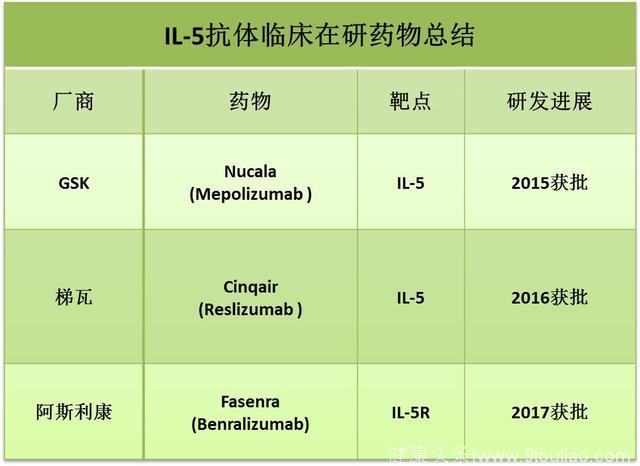
Source: clinical trial database
白细胞介素4和13(IL-4/IL-13)IL-4和IL-13是两个哮喘发病中重要的细胞因子,它们可以诱导B细胞产生更多的IgE,从而促使呼吸道粘液分泌增多、支气管纤维化以及呼吸道超敏。IL-4和IL-13在蛋白结构上有一定的相似度,它们都可以通过结合IL-4α受体和IL-13α受体形成的复合体去激发下游的分子通路。
目前已经有两个针对IL-13的抗体药物在三期临床试验,但是疗效并没有完全得到肯定。
由罗氏研发的lebrikizumab已经进行了两个平行的临床三期试验:LAVOLTA1和LAVOLTA2, 但是两个试验得到的结果却不尽相同。LAVOLTA1试验显示lebrikizumab显著降低了哮喘病人的恶化率,但是LAVOTA2试验却没有达到同样的疗效。此后,罗氏将lebrikizumab授权给Dermira,后者计划将其发展为异位性皮炎药物。
阿斯利康的IL-13单抗tralokinumab也在其中一个三期临床试验中未能达到首要终点。辉瑞的IL-13单抗anrukinzumab已经在哮喘患者中做了二期临床试验,但是却默默地从辉瑞的研发管线中消失了。因此,IL-13抗体治疗哮喘的有效性还需要更确切的临床试验结果来支撑。
IL-4受体(IL-4R)单抗在哮喘的临床实验中取得了不错的结果。2017年9月份,赛诺菲的IL-4Rα单抗dupilumab在其不可控持续性哮喘三期临床实验中,显著降低了病人的恶化率,且明显改善了病人的肺功能。此外,能同时结合IL-4和IL-13的双特异性抗体也已进入早期临床试验。
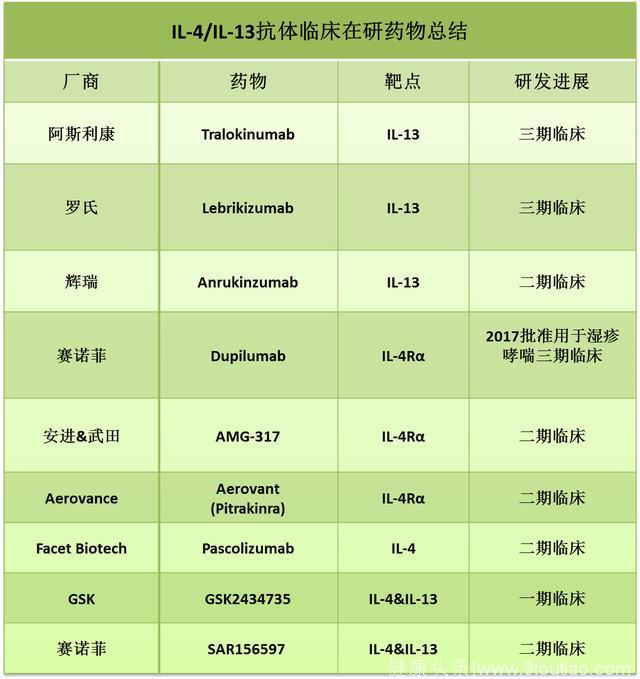
Source: clinical trial database
其他哮喘抗体靶点哮喘免疫反应中的其他分子也极有潜力成为治疗靶点。
这其中包括针对2型炎症细胞因子:IL-6,IL-9,IL-17,IL-23,IL-33,OX40配体(OX40L)和GM-CSF (粒细胞-巨噬细胞集落刺激因子,gramulocyte-macrophase colony-stimulating factor)的抗体;
针对细胞因子受体:IL-2Rα,IL-17Rα,以及IL-33R的抗体。
其中一些单抗已经获批用于治疗其他疾病,比如daclizumab(IL-2Rα单抗)已经获批用于治疗多发性硬化症(MS),secukinumab(IL-17单抗)和brodalumab(IL-17Rα单抗)获批用于中度至重度斑块型银屑病(plaque psoriasis)的治疗。这些药物也在进行哮喘治疗的临床试验。
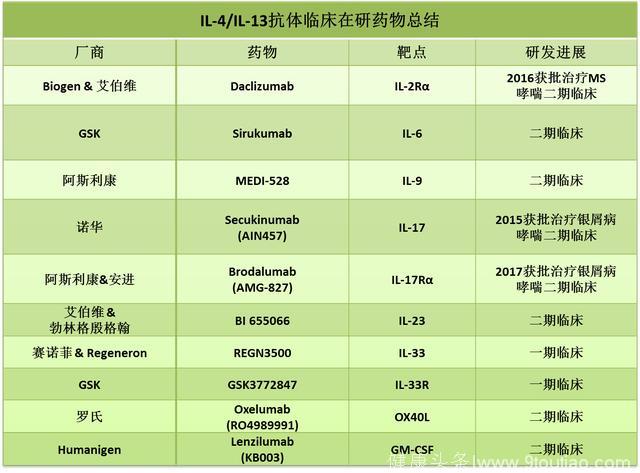
Source: clinical trial database
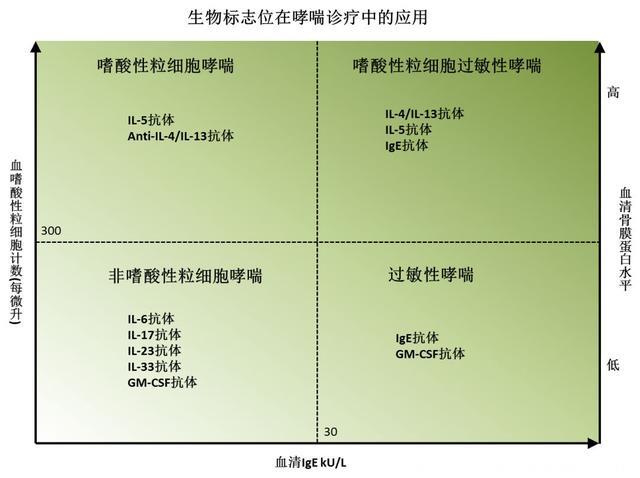
生物标志物:个性化诊疗的关键严重和不可控哮喘的治疗和管理一直以来都很具有挑战性,病人常常具有很大的异质性,个体和个体间的差异很大,因此结合生物标志物和抗体药物的个性化治疗势在必行。
目前,常用的临床试验生物标志物包括:血清IgE水平,呼出气一氧化氮水平(fractional exhaled nitric oxide,FeNO),痰液细胞计数,血细胞计数(尤其是嗜酸性粒细胞计数),血清骨膜蛋白(periostin)水平等。
大多数情况下,我们需要至少两个生物标志物才能确认哮喘的分型和使用合适的抗体药物。
抗体药物的出现,部分解决了药物指南对严重不可控哮喘束手无策的尴尬,因为抗体药物可以直接调节诱发哮喘的免疫。目前批准用于治疗哮喘的抗体种类主要是IgE单抗,IL-5单抗和IL-5R单抗。
抗体药物疗效的日益凸显,IgE单抗和IL-5单抗已经被GINA列入指南,作为严重和不可控哮喘病人的附加疗法,其市场必将进一步扩张。当然其中一些靶点的研发路途相对坎坷,比如IL-4/IL-13类抗体,相继默默的消失在大公司的研发管线中。
美国FDA专家也对IL-6抗体(sirukumab)治疗哮喘给出了不推荐的意见,因为担心其增加上呼吸道感染的风险。另一方面,一些抗体比如IL-17单抗,IL-2Rα单抗,已经获批用于治疗其他疾病,如果它们在哮喘的临床试验中获得成功,其获批的速度一定会更快。
我们还应该注意到目前成功的抗体药物只对嗜酸性粒细胞哮喘(多为2型炎症)疗效确切,病人需要满足一定的生物指标(如血液中嗜酸粒细胞计数大于300每微升)才可使用。
对于那些非嗜酸性粒细胞严重哮喘的病人,还没有太好的抗体靶点。另外,如何做到在调节免疫系统的同时又不增加上呼吸道感染带来的恶化风险,也是研发过程中需要解决的问题。
可以肯定的是,在肿瘤抗体药物战场如火如荼的同时,哮喘领域竞争的烽火也将越烧越旺,必将成为呼吸系统药物的必争之地。
参考文献:1. Sears, M.R., Trends in the prevalence of asthma. Chest, 2014. 145(2): p. 219-225.
2. 2017 GINA Report, Global Strategy for Asthma Management and Prevention
3. Holgate ST, Wenzel S, Postma DS, Weiss ST, Renz H, Sly PD. Asthma. Nat Rev DisPrimers. 2015 Sep 10;1:15025.
4. Chung, Kian Fan, Targeting the interleukin pathway in the treatment of asthma, The Lancet , Volume 386 , Issue 9998 , 1086 – 1096
5. Hanania, N.A., et al., Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA I and LAVOLTA II): replicate, phase 3, randomised, double-blind, placebo-controlled trials. Lancet Respir Med, 2016. 4(10): p. 781-796.
6. Pavord, I.D., et al., Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet, 2012. 380(9842): p. 651-9.
7. Wenzel, S., et al., Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med, 2013. 368(26): p. 2455-66.
8. Malinovschi, A., et al., Simultaneously increased fraction of exhaled nitric oxide levels and blood eosinophil counts relate to increased asthma morbidity. J Allergy Clin Immunol, 2016. 138(5): p. 1301-1308 e2.
9. Corren, J., et al., Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med, 2017. 377(10): p. 936-946.


本期作者:任晓远
本科毕业于北京大学药学院,于瑞典卡罗林斯卡医学院获得硕士和博士学位。现就职于卡罗林斯卡医学院,从事抗肿瘤和抗生素药物研发相关课题,长期关注医药行业研发动态,同时担任北欧华人创新创业协会秘书长。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
