NEJM|深度分析:降糖药物的心血管获益
小谢说:目前,全世界有超过4.5亿人患有糖尿病,全球患病率为9.3%[1-2],其中T2DM占90%~95%,主要并发症包括微血管疾病(视网膜、神经和肾脏病变)和大血管疾病(冠心病、周围血管以及脑血管疾病),且病理生理机制较为复杂[3-5]。据统计,糖尿病患者患动脉粥样硬化性心血管疾病的患病率是非糖尿病患者的两倍以上,并且女性患冠心病的相对风险高于男性[6]。
近日,新英格兰医学杂志(NEJM)发表了一篇有关具心血管获益的2型糖尿病(T2DM)药物的研究,通过引出临床实践病案了解相关药物的选择,为临床医生提供了新的思路。

患者女,64岁,既往T2DM病史10年;4年前有过心梗病史,高血压和高脂血症病史,病情控制尚可。目前用药:二甲双胍2g/d,氯沙坦,氢氯噻嗪,高强度阿托伐他汀和阿司匹林。平时未规律监测血糖。查体:BP:128/75 mmHg,BMI:33 kg/m2。实验室检查:HbA1c:7.9%,TC:4.0 mmol/L,HDL-C:1.34 mmol/L,Tg:1.4 mmol/L,LDL-C:2.0 mmol/L。eGFR:76 ml/min,尿白蛋白与肌酐比值(ACR):25 mg/g。
在糖尿病诊断和整个病程中都强调生活方式管理,根据糖尿病临床指南,管理心血管危险因素与预防性药物的使用同样重要,如肥胖、饮食、缺乏运动、高血压、血脂异常和吸烟[3,7,8]。
一项涉及T2DM患者的小型试验中,与传统疗法相比,在多因素(生活方式的改变及针对心血管危险因素的药物治疗)强化干预下心血管事件风险显着降低[9]。然而,一项关于T2DM超重或肥胖参与者的大型随机试验表明,与常规糖尿病宣教指导相比,强化生活方式的干预措施虽能促进减重,降低若干心血管疾病危险因素,但未显着降低心血管事件的发生率[10]。
因此,无论其血糖目标如何,目前大多数专业协会建议对已确诊动脉粥样硬化性心血管疾病的T2DM患者和具有心血管疾病高风险的特定患者使用药物来降低心血管风险[3,4]。
下文描述了各类降糖药物对心血管疾病风险的影响(表1-3)。
在UKPDS 33研究中发现与常规治疗相比,在接受胰岛素治疗的患者中未发现心梗或糖尿病相关死亡风险的增加[9]。此外,在一项研究中发现,与标准治疗(非药物治疗或二甲双胍或磺脲类)相比,具有心血管疾病、糖尿病前期或T2DM风险的患者使用甘精胰岛素对6年后心血管结局是中性的[12]。另一项涉及T2DM患者的试验结果(85%患有心血管疾病或中度慢性肾病)显示,在超过2年的心血管结局发生率方面,超长效胰岛素德谷胰岛素和甘精胰岛素没有显著差异[13]。
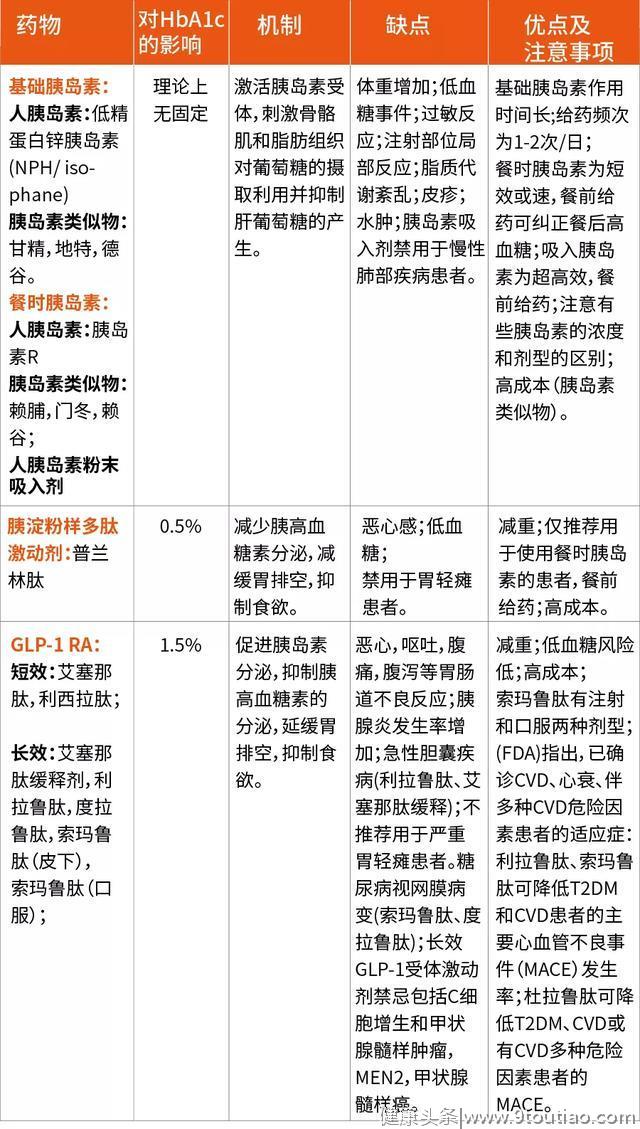
表1 目前T2DM药物、机制、优缺点及注意事项
尽管对于第一代磺脲类药物甲苯磺丁脲增加心血管疾病的风险仍存担忧,但迄今为止,该药物的说明书上仍有关于心血管疾病死亡风险的警告。
与常规治疗相比,在UKPDS试验中,接受磺酰脲类药物(氯丙酰胺或格列本脲)治疗的受试者中未出现心梗或糖尿病相关死亡的风险[14]。此外,包括第二和第三代磺脲类药物(格列吡嗪、格列本脲和格列美脲)试验在内的荟萃分析也未提示心梗或心血管疾病死亡的总风险增加[15]。
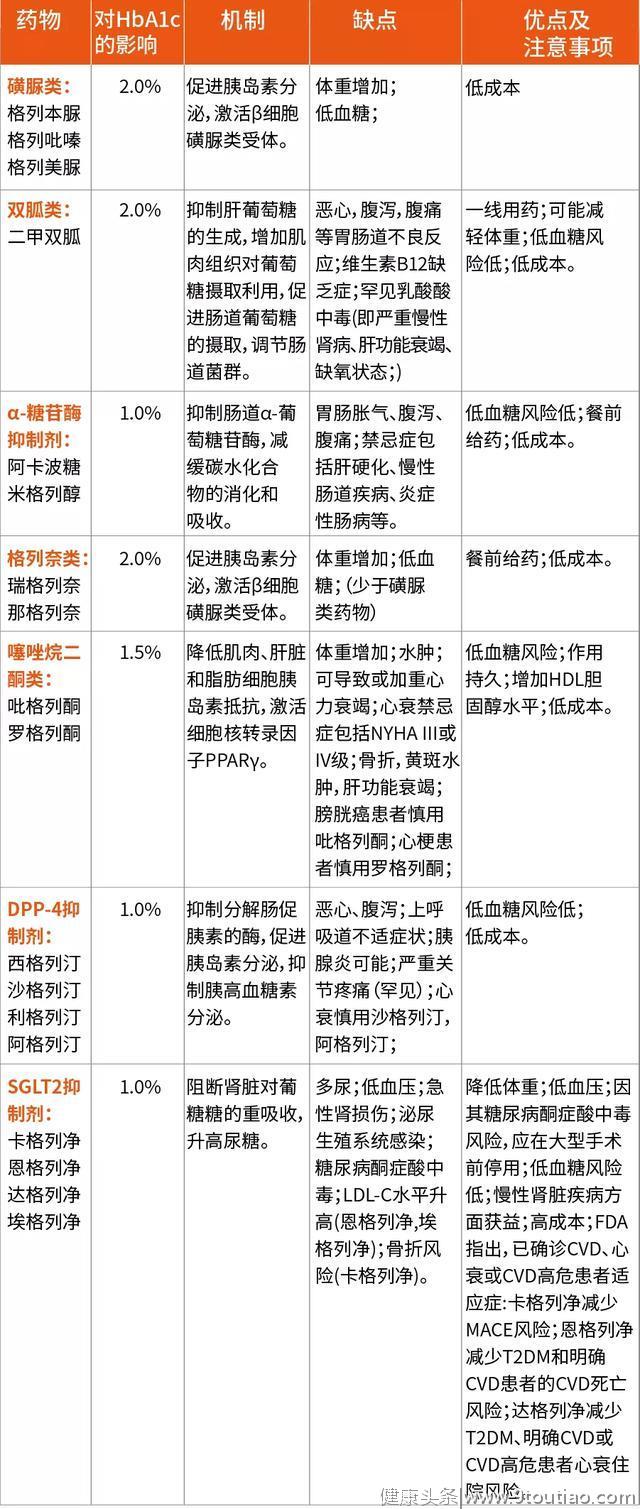
表2 目前T2DM药物、机制、优缺点及注意事项
二甲双胍是多数T2DM患者的首选药物。UKPDS 34研究结果提示其心血管获益[16]。对753名初发T2DM的超重受试者进行二甲双胍强化或常规治疗(平均HbA1c水平分别为7.4%和8.0%),在10年的试验期内,发现接受二甲双胍治疗的受试者心梗(39%)和糖尿病相关死亡(42%)风险显著降低,并且在随后的长期观察中仍获益[10]。然而,一项包括该试验和其他小型试验的荟萃分析结果表明,由于数据有限,二甲双胍是否能降低心血管疾病的风险还不能完全确定[17]。
尽管在纳入了42项研究的大型荟萃分析中发现罗格列酮(噻唑烷二酮类)可显著增加心梗和心血管疾病死亡风险,但该分析中纳入的多项试验较小,且研究时间较短[18],在随后使用不同分析方法后也没有证实这一发现[35]。
此外,一项大型试验中,罗格列酮(联合二甲双胍或磺酰脲类药物)与对照组相比(二甲双胍加磺酰脲类药物),结果并未证明罗格列酮可增加心血管风险[19]。在一项T2DM和大血管疾病患者服用吡格列酮的安慰剂对照试验中,两组患者发生主要复合终点事件的风险没有显著差异,但发现吡格列酮可降低次要复合终点事件的风险,包括不同原因的死亡,非致死性心肌梗死和中风事件[20]。此外,吡格列酮还可降低胰岛素抵抗(无糖尿病)和近期缺血性中风病史患者发生心血管事件的风险[21]。
研究α-葡萄糖苷酶抑制剂对T2DM患者心血管影响的大型试验尚未进行。但在一项涉及冠心病和糖耐量减低患者的大型随机试验中,接受5年以上阿卡波糖和安慰剂治疗的患者发生主要心血管终点事件的风险一致[22]。
DPP-4抑制剂在心血管结局相关试验中,DPP-4抑制剂的疗效及安全性不低于安慰剂组。然而研究发现沙格列汀可显著增加心衰患者住院风险[23]。在一项大型随机试验中发现利格列汀在6年内主要心血管不良结局的风险与磺脲类格列美脲相当[24]。
研究发现,特异性GLP-1受体激动剂在降低非致命性心肌梗死、非致命性中风、心血管疾病和心血管疾病死亡事件发生率方面优于安慰剂组,其中,利拉鲁肽(风险比,0.87;95%可信区间[CI],0.78-0.97)和注射用索马鲁肽(风险比,0.74;95%可信区间,0.58-0.95)的风险降低优势最为突出(表3)。
在一项涉及心血管疾病高风险患者的试验中(心血管疾病患者占32%),发现使用度拉鲁肽可显著降低心血管结局(风险比,0.88;95%CI,0.79至0.99)[13]。另一项有关心血管疾病或慢性肾脏病患者的试验中发现,在进行中位随访16个月后,口服索马鲁肽的疗效不劣于安慰剂组[25]。
SGLT2抑制剂在一项主要涉及T2DM和心血管疾病的安慰剂对照试验中发现,使用特定SGLT2抑制剂(包括恩格列净(风险比,0.86;95%CI,0.74~0.99)和卡格列净(风险比,0.86;95%CI,0.75~0.97)可降低非致命性心肌梗死、非致命性中风或心血管疾病死亡事件的发生率[26]。
并且在一项主要包括心血管疾病高风险患者的试验中发现,达格列净能显著降低主要结局即心血管疾病或心衰住院患者的死亡率(风险比,0.83;95%CI,0.73-0.95)[27]。
此外,所有目前可用的SGLT2抑制剂都能显著降低因心衰住院的次要结局发生率。在射血分数降低的心力衰竭患者中,无论是否患有糖尿病,与安慰剂相比,达格列净或恩格列净可显著降低因心血管疾病死亡或心力衰竭住院的风险[28]。
在慢性肾病和T2DM患者的安慰剂对照试验中,卡格列净和达格列净也被证实能显著降低肾功能衰竭和心血管或肾脏疾病死亡的风险(达格列净对其他慢性肾脏疾病患者亦有效)[29]。此外,对T2DM患者和近期心力衰竭恶化患者进行的SGLT1-SGLT2双重抑制剂的安慰剂对照试验也证实其心血管获益。
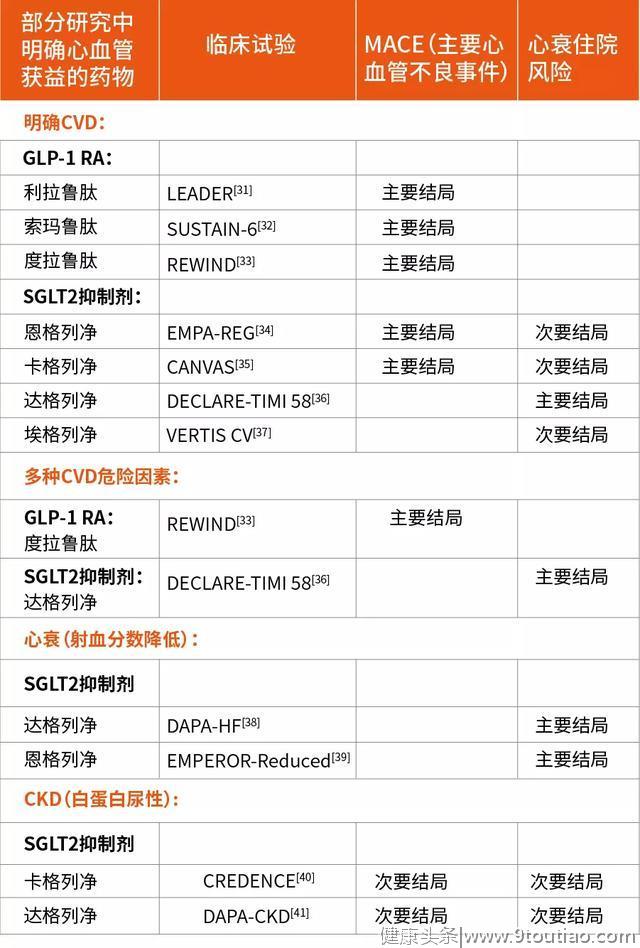
表3 目前具有心血管获益的降糖药物
对于SGLT2抑制剂和GLP-1受体激动剂的心血管作用,目前已提出几种机制,目前尚不确定其获益是否为药物特异性[3,4]。并且由于糖化血红蛋白(HbA1c)目标值低于6.5%或7.0%的患者以及没有或心血管危险因素较少的患者未纳入心血管结局试验,因此尚不清楚这些结果是否可以推广到所有患者中。此外,目前尚不清楚GLP-1受体激动剂和SGLT2抑制剂的联合应用是否比单独使用二者带来更多的心血管益处。
大部分GLP-1受体激动剂和SGLT2抑制剂的长期不良反应尚需进一步研究。目前,由于缺乏对较老且成本较低的药物的大规模试验,因此其心血管作用仍不明确。尽管心血管结局试验中约3/4的参与者服用了二甲双胍,但分析表明,无论是否使用二甲双胍治疗,其最终心血管结局无明显差异[30],并且对于其在动脉粥样硬化性心血管疾病患者中的使用仍存争议。目前正在进行相关试验以明确二甲双胍对糖尿病前期和动脉粥样硬化性心血管疾病患者的心血管结局。
各类指南建议大同小异,大多数指南仍建议将二甲双胍作为T2DM治疗的一线用药[3,4,17-21]。美国、加拿大以及欧洲的多个专业组织发布的指南建议对符合标准的患者(包括已确诊的心血管疾病患者和某些心血管疾病高风险患者)优先考虑使用SGLT2抑制剂和GLP-1受体激动剂类具有明显心血管获益的降糖药物[3,4,17,18,20]。
开篇引出的病例中所描述的患者患有T2DM,其病程长,且患有动脉粥样硬化性心血管疾病。对于该患者,除了提供饮食建议外,应建议患者增加运动量,临床医师应积极处理心血管疾病的其他危险因素,并予已证实具有心血管获益的降糖药物。
目前推荐GLP-1受体激动剂和SGLT2抑制剂类药物。而对于射血分数降低的糖尿病和心力衰竭患者或慢性肾脏疾病患者,应考虑具有心血管或肾脏益处的SGLT2抑制剂。同时,鉴于该患者为肥胖人群,推荐在减重方面优于SGLT2抑制剂的GLP-1受体激动剂的使用。
此外,对患者进行糖尿病宣教至关重要,应鼓励患者规律监测血糖水平,并建议在3个月内进行临床随访和重新评估糖化血红蛋白水平。
文/迪娜
责编/Jane
参考文献
[1] Saeedi P, Petersohn I, Salpea P, et al. Global and regional Diabetes prevalence estimates for 2019 and projections for 2030 and 2045: results from the International Diabetes Federation Diabetes Atlas,9th ed. Diabetes Res Clin Pract 2019;157: 107843.
[2] Weyer C, Bogardus C, Mott DM, Pratley RE. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J Clin Invest 1999;104:787-94.
[3] American Diabetes Association. 10. Cardiovascular disease and risk management: Standards of medical care in diabetes–2021. Diabetes Care 2021;44:Suppl 1: S125-S150.
[4] Das SR, Everett BM, Birtcher KK, et al. 2020 expert consensus decision pathway on novel therapies for cardiovascular risk reduction in patients with type 2 diabetes: a report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol 2020;76:1117-45.
[5]Orasanu G, Plutzky J. The pathologic continuum of diabetic vascular disease. J Am Coll Cardiol 2009;53:S35-S42.
[6] Peters SA, Huxley RR, Woodward M. Diabetes as risk factor for incident coronary heart disease in women compared with men: a systematic review and metaanalysis of 64 cohorts including 858,507 individuals and 28,203 coronary events. Diabetologia 2014;57:1542-51.
[7] Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998;339:229-34.
[8] Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA guideline on the primary prevention of cardiovascular disease: executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019;140(11):e563-e595.
[9] Wing RR, Bolin P, Brancati FL, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013;369:145-54.
[10] Gaede P, Vedel P, Larsen N, Jensen GV, Parving HH, Pedersen O. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med 2003;348:383-93.
[11] Erpeldinger S, Rehman MB, Berkhout C, et al. Efficacy and safety of insulin in type 2 diabetes: meta-analysis of randomised controlled trials. BMC Endocr Disord 2016;16:39.
[12] Gerstein HC, Bosch J, Dagenais GR, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012;367:319-28.
[13] Marso SP, McGuire DK, Zinman B, et al. Efficacy and safety of degludec versus glargine in type 2 diabetes. N Engl J Med 2017;377:723-32.
[14]Meinert CL, Knatterud GL, Prout TE, Klimt CR. A study of the effects of hypoglycemic agents on vascular complications in patients with adult-onset diabetes: II. Mortality results. Diabetes 1970; 19:Suppl:789-830.
[15] Varvaki Rados D, Catani Pinto L, Reck Remonti L, Bauermann Leitão C, Gross JL. The association between sulfonylurea use and all-cause and cardiovascular mortality: a meta-analysis with trial sequential analysis of randomized clinical trials. PLoS Med 2016;13(4):e1001992.
[16] UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998;352: 854-65.
[17] Griffin SJ, Leaver JK, Irving GJ. Impact of metformin on cardiovascular disease: a meta-analysis of randomised trialsamong people with type 2 diabetes. Diabetologia 2017;60:1620-9.
[18] Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007;356:2457-71.
[19] Mahaffey KW, Hafley G, Dickerson S,et al. Results of a reevaluation of cardiovascular outcomes in the RECORD trial. Am Heart J 2013;166(2):240-249.e1.
[20] Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005;366:1279-89.
[21] Kernan WN, Viscoli CM, Furie KL, et al. Pioglitazone after ischemic stroke or transient ischemic attack. N Engl J Med 2016;374:1321-31.
[22] Holman RR, Coleman RL, Chan JCN, et al. Effects of acarbose on cardiovascular and diabetes outcomes in patients with coronary heart disease and impaired glucose tolerance (ACE): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2017;5:877- 86.
[23] Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369:1317-26.
[24] Rosenstock J, Kahn SE, Johansen OE, et al. Effect of linagliptin vs glimepiride on major adverse cardiovascular outcomes in patients with type 2 diabetes: the CAROLINA randomized clinical trial. JAMA 2019;322:1155-66.
[25] Husain M, Birkenfeld AL, Donsmark M, et al. Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2019;381:841-51.
[26] Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117-28.
[27] Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347-57.
[28] Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413-24.
[29] Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383:1436-46.
[30] Neuen BL, Arnott C, Perkovic V, et al. Sodium-glucose co-transporter-2 inhibitors with and without metformin: a metaanalysis of cardiovascular, kidney and mortality outcomes. Diabetes Obes Metab 2021;23:382-90.
[31] Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375:311-22.
[32] Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016;375:1834-44.
[33] Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019;394:121-30.
[34] Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117-28.
[35] Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017;377:644-57.
[36] Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347-57.
[37] Cannon CP, Pratley R, Dagogo-Jack S, et al. Cardiovascular outcomes with ertugliflozin in type 2 diabetes. N Engl J Med 2020;383:1425-35.
[38] McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in patients with tion. N Engl J Med 2019;381:1995-2008.
[39] Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413-24.
[40] Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019;380:2295-306.
[41] Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383:1436-46.