“修复”人体葡萄糖传感器:播种糖尿病治疗的新希望!
多扎格列艾汀单药或联合二甲双胍,带来了治疗糖尿病的希望之光。
因为“发现葡萄糖激酶(Glucokinase, GK)作为血糖调节的传感器,感受葡萄糖浓度,调节胰腺中β细胞的胰岛素分泌水平,以及参与进入III期研究的创新GKA*研发的杰出成就“,2020年的内分泌学界的诺贝尔奖Rolf Luft Award颁发给了宾夕法尼亚大学的Franz Matschinsky教授。这一大奖的获得,充分肯定了Franz Matschinsky教授提出的关于“调控人类胰岛细胞和其他组织中的葡萄糖激酶(GK),可纠正2型糖尿病中的代谢缺陷”的理论。
(*注:为华领医药的多扎格列艾汀Dorzagliatin)

基于上述理论的葡萄糖激酶激活剂(Glucokinase Activator, GKA)诞生并曾在掀起全球研发的热潮。作为华领医药的高级科学顾问,Franz Matschinsky教授与华领医药一直共同探索葡萄糖激酶(GK)在人体血糖稳态调控中所发挥的核心作用。华领医药在研的全球首创新药多扎格列艾汀(Dorzagliatin)是目前唯一已进入且完成Ⅲ期临床研究的葡萄糖激酶激活剂(GKA),引来内分泌学术界的高度关注。就在刚刚结束的中华医学会糖尿病学分会第二十四次全国学术会议上,多位糖尿病领域大咖围绕葡萄糖激酶(GK)的作用机制、多扎格列艾汀(Dorzagliatin)临床研究进展进行了精彩分享。
葡萄糖激酶(GK)损伤:
血糖失衡的重要“推手”
人体对葡萄糖的摄取和利用是一个复杂又精妙的过程,在这个过程中,一种独特的功能蛋白——己糖激酶(HK)发挥着重要的作用。其中己糖激酶家族中唯一可以作为葡萄糖传感器的葡萄糖激酶(GK),又称己糖激酶IV(HK-IV)——在人体血糖稳态调节中扮演关键角色。围绕葡萄糖激酶(GK)在血糖稳态调节中的作用,复旦大学附属中山医院李小英教授的精彩论述徐徐展开。
葡萄糖激酶(GK)主要分布在胰岛、肝脏和肠道等部位,起着葡萄糖传感器的功能,其激活由葡萄糖浓度来决定,进而通过调节控糖激素,即胰岛素和胰高糖素的分泌,以及糖原合成,来维持葡萄糖稳态1。多个器官中的葡萄糖激酶(GK)联手进行血糖调控:血糖过高时,胰岛β细胞中葡萄糖激酶(GK)活性增加,调节胰岛素适时适量的分泌;肝细胞中葡萄糖激酶(GK)活性增加,促进肝糖原合成;同时α细胞中葡萄糖激酶(GK)活性增强,抑制胰高糖素释放;反过来,血糖过低时,α细胞中葡萄糖激酶(GK)活性下降,启动胰高糖素及时分泌,使血糖上升至生理目标范围。在肠道内L细胞 中,随着葡萄糖水平增加,葡萄糖激酶(GK)激活启动胰高糖素样肽-1(GLP-1)分泌,GLP-1又可进一步促进β细胞的葡萄糖激酶(GK)活性,同时促进胰岛素分泌增加。就是这样,葡萄糖激酶(GK)作为葡萄糖传感器,将血糖水平控制在4~6.5mmol/L的目标区间内,维持人体的血糖稳态2(图1)。李小英教授作了个形象的比喻:这就类似于智能空调中传感器对温度的感知和传递功能,让智能空调设定一个舒适的温度范围。

图1:葡萄糖激酶(GK)在血糖重要调控器官发挥葡萄糖传感器的功能,调控和维持血糖稳态
葡萄糖激酶(GK)在人体血糖稳态调控系统中起核心作用,其受损将导致葡萄糖稳态失衡,是血糖升高的重要“推手”。研究表明,T2DM患者胰岛和肝脏葡萄糖激酶(GK)表达严重降低3,4,而且肝脏葡萄糖激酶(GK)活性显著下降5,6,造成稳态调控系统对血糖变化的敏感性降低,因此血糖大幅波动,稳态失控。
“赋能”葡萄糖激酶(GK):
播种恢复血糖稳态的希望
葡萄糖激酶激活剂(GKA)可与活性构象葡萄糖激酶(GK)结合,血糖依赖性地调节葡萄糖激酶(GK)返回到非活性构象,提高对葡萄糖的敏感性7。葡萄糖激酶(GK)“赋能”后,就有了恢复血糖稳态的希望。
南京大学医学院附属鼓楼医院朱大龙教授介绍说,全球目前有5个葡萄糖激酶激活剂(GKA)在研发过程中,其中华领医药多扎格列艾汀(Dorzagliatin)是目前唯一已进入且完成Ⅲ期临床研究的葡萄糖激酶激活剂(GKA)。值得一提的是,多扎格列艾汀(Dorzagliatin)是全球首创的葡萄糖激酶双重激活剂,化学结构独特,提高激酶催化效率,保持激酶葡萄糖浓度依赖,且能同时作用于胰岛和肝脏,修复T2DM患者受损的葡萄糖传感器功能。同时,它的药代动力学参数优异,在5-200mg剂量区间,显示明确的剂量和血中暴露量线性关系,吸收代谢分布排泄性质支持与广泛的口服降糖药物联合使用,并没有种族差异8。
通过修复葡萄糖激酶(GK)活性,多扎格列艾汀(Dorzagliatin)有提高对葡萄糖的敏感性,改善胰岛素早相分泌和肝脏葡萄糖的储备功能,重塑血糖稳态的潜力。基础研究显示,多扎格列艾汀(Dorzagliatin)可提升糖尿病大鼠胰岛素分泌细胞数量至正常大鼠的75%,提升其肝脏葡萄糖激酶(GK)表达,恢复至正常表达量的80%9。在Ⅰ期临床研究中,多扎格列艾汀(Dorzagliatin)治疗7天后,胰岛对血糖的敏感性即明显改善,C肽分泌时相前移,胰岛素早相分泌得以改善10,11。
Ⅱ期探索性研究显示,多扎格列艾汀(Dorzagliatin)治疗12周,各剂量组血糖均持续下降,其中75mg BID组糖化血红蛋白(HbA1c)相比基线降幅达1.12%,显著优于安慰剂(图2),餐后2小时血糖也较基线显著降低达4.9mmol/L,同时,处置指数(DI)和HOMA-IR评分显著改善,即使治疗结束后1周,患者的DI和HOMA-IR评分仍然显著改善,提示停药后疗效的持续性12。而且,治疗期间没有发生药物相关的严重不良事件(SAE)或严重的低血糖事件12,提示多扎格列艾汀(Dorzagliatin)具有良好的耐受性和安全性。

图2:与安慰剂相比,Dorzagliatin 75mg BID治疗后HbA1c降幅显著更优
进入Ⅲ期临床研究(播种研究,SEED)的多扎格列艾汀(Dorzagliatin),表现依然优秀。多中心、随机、双盲安慰剂对照的SEED研究是全球首个GKA,纳入463例未使用糖尿病治疗药物的初治2型糖尿病(T2DM)患者,以2:1随机分配至多扎格列艾汀(Dorzagliatin)组或安慰剂组治疗13。研究显示:
与安慰剂相比,多扎格列艾汀(Dorzagliatin)75mg BID单药治疗24周后HbA1c相对基线降幅度显著更优(-1.07%vs -0.5%, p,HbA1c的血糖稳态达标率显著更高(45% vs 21.5%, p;
更显著改善β细胞功能(HOMA2-β)(图4);
至治疗52周时,HbA1c较基线下降1.11%(p, 疗效持续显著稳定13,(图5)13, 提示多扎格列艾汀(Dorzagliatin)单药长期治疗降糖效果仍持续稳定。

图3:与安慰剂相比,Dorzagliatin 75mg BID单药治疗HbA1c降幅显著更优,血糖稳态达标率显著更高

图4:与安慰剂相比,Dorzagliatin 75mg BID单药治疗显著改善β细胞功能
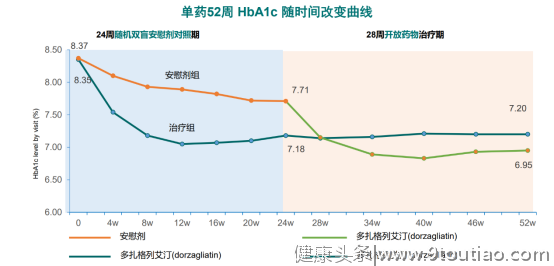
图5:多扎格列艾汀(Dorzagliatin)单药长期52周治疗降糖效果仍持续稳定
在特殊人群的用药方面,朱大龙教授介绍了在肾功能损伤患者中的药物代谢动力学研究。该研究发现,Dorzagliatin可以用于患有慢性肾脏病各个阶段的T2DM患者且无需调整剂量。
迎来黎明之光:
行进在希望的田野上
2019年发表在Diabetes care杂志的一项研究表明,积极治疗期间改血糖的降糖药物,包括二甲双胍GLP-1激动剂、甘精胰岛素,在停药后未能产生持久的益处14,因此现有降糖药物尚未解决糖尿病的根本原因,该何去何从?中日友好医院杨文英教授认为,葡萄糖激酶(GK)是血糖稳态的核心“元件”,需要恢复这个葡萄糖传感器功能,才能进一步优化血糖管理效果。
多扎格列艾汀(Dorzagliatin)可作用在血糖调控的核心器官(胰岛和肝脏),旨在治标治本,恢复血糖调控的生理机制。Ⅲ期临床研究DAWN研究(黎明研究)是多中心、随机、双盲安慰剂对照研究,纳入766例二甲双胍单药治疗不佳的T2DM患者,以1:1随机分配至多扎格列艾汀(Dorzagliatin)或安慰剂组治疗双盲治疗24周以及开放标签治疗28周。
研究结果显示:
与安慰剂相比,多扎格列艾汀(Dorzagliatin)与二甲双胍联合治疗HbA1c较基线降幅显著更优(-1.02% vs 0.36%,p,HbA1c达标率显著更高(44.4% vs 10.7% p<0.0001)(图7);
空腹血糖显著降低更多(-0.67mmol/L vs -0.29mmol/L, , p=0.0091),餐后2小时血糖显著降低更多(-5.45mmol/L vs -2.97mmol/L, , p;
显著改善β 细胞功能和胰岛素抵抗: 多扎格列艾汀治疗组HOMA2-β增加了3.77%,安慰剂对照组增加了1.35%; 多扎格列艾汀治疗组HOMA2-IR也较对照组明显改善;
同时24周治疗期内,具有临床意义的低血糖(血糖发生率

图6:与安慰剂相比,Dorzagliatin与二甲双胍联合治疗HbA1c降幅显著更优

图7:与安慰剂相比,Dorzagliatin与二甲双胍联合治疗HbA1c达标率显著更高

图8:与安慰剂相比,Dorzagliatin与二甲双胍联合治疗空腹血糖与餐后血糖下降更显著
此外, 其他的联合治疗I期研究,也让我们看到多扎格列艾汀(Dorzagliatin)良好的联用前景:
多扎格列艾汀(Dorzagliatin)与DPP4抑制剂(西格列汀)或SGLT2抑制剂(恩格列净)联合治疗时,不影响各自的药代动力学参数;
与单药相比,联合治疗降糖效果增加更明显;
多扎格列艾汀(Dorzagliatin)与西格列汀联用后,半小时内GLP-1水平就较单用西格列汀明显增加;
多扎格列艾汀(Dorzagliatin)与恩格列净联用后,早相C-肽水平也明显升高。
总结
作为维持人体血糖稳态的核心“元件”, 葡萄糖激酶(GK)的损伤是T2DM患者血糖稳态失衡的重要“推手”。在T2DM的治疗中,需要恢复这个葡萄糖传感器功能,才能进一步优化血糖管理效果。全球首创的在研葡萄糖激酶双重激活剂多扎格列艾汀(Dorzagliatin)可作用于血糖调控的核心器官(胰岛和肝脏),具有修复葡萄糖激酶(GK)活性,提高对葡萄糖的敏感性,改善胰岛素早相分泌和葡萄糖的储备功能,重塑血糖稳态的潜力,旨在从源头上治疗糖尿病。两项III期临床研究表明,多扎格列艾汀(Dorzagliatin)单药或联合二甲双胍均有效降低HbA1c,显著改善胰岛β细胞功能和胰岛素抵抗,耐受性和安全性良好,带来了治疗糖尿病的希望之光。
2020年8月17日,华领医药与拜耳集团就处于临床试验阶段的首创糖尿病治疗药物多扎格列艾汀(Dorzagliatin)在中国达成商业合作协议,此项协议将发挥拜耳在中国糖尿病管理领域的领先优势以及华领医药的创新能力,为中国糖尿病患者提供全新的治疗方案选择。
资料来源:
1. Irwin DM, Tan H. Molecular evolution of the vertebrate hexokinase gene family: Identification of a conserved fifth vertebrate hexokinase gene. Comp Biochem Physiol Part D Genomics Proteomics, 2008, 3(1):96-107.
2. MatschinskyFM, WilsonDF. The central role of glucokinase in glucose homeostasis: a perspective 50 years after demonstrating the presence of the enzyme in islets of Langerhans. Front Physiol, 2019, 10:148-163.
3. Li C, Liu C, Nissim I, et al. Regulation of glucagon secretion in normal and diabetic human islets by γ-hydroxybutyrate and glycine. J Biol Chem, 2013, 288(6):3938-51.
4. Haeusler RA, Camastra S, Astiarraga B, et al. Decreased expression of hepatic glucokinase in type 2 diabetes. Mol Metab. 2014, 4(3):222-6.
5. Caro JF, Triester S, Patel VK, et al. Liver glucokinase: decreased activity in patients with type II diabetes. Horm Metab Res, 1995, 27(1):19-22.
6. Clore JN, Stillman J, Sugerman H. Glucose-6-phosphatase flux in vitro is increased in type 2 diabetes. Diabetes. 2000, 49(6):969-74.
7. Grewal AS, Sekhon BS, Lather V. Recent updates on glucokinase activators for the treatment of type 2 diabetes mellitus. Mini Rev Med Chem. 2014, 14(7):585-602.
8. Li Chen, Y Zhang, et al. ADA 75th Scientific Session, June 5-9, 2015, Boston.
9. Wang P, Liu H, Chen L, et al. Effects of a Novel Glucokinase Activator, HMS5552, on Glucose Metabolism in a Rat Model of Type 2 Diabetes Mellitus. J Diabetes Res, 2017, 2017:5812607.
10. Bergstrom RW, Wahl PW, Leonetti DL, Fujimoto WY. Association of fasting glucose levels with a delayed secretion of insulin after oral glucose in subjects with glucose intolerance. J Clin Endocrinol Metab, 1990, 71(6):1447-53.
11. DL Zhu, et al. ADA 75th Scientific Session, 2015, Boston.
12. Zhu D, Gan S, Liu Y, et al. Dorzagliatin monotherapy in Chinese patients with type 2 diabetes: a dose-ranging, randomised, double-blind, placebo-controlled, phase 2 study. Lancet Diabetes Endocrinol, 2018, 6(8):627-636.
13. Hua Medicine for 2020 ADA Scientific Sessions.
14. RISE Consortium. Lack of Durable Improvements in β-Cell Function Following Withdrawal of Pharmacological Interventions in Adults With Impaired Glucose Tolerance or Recently Diagnosed Type 2 Diabetes. Diabetes Care, 2019, 42(9):1742-1751.
校对:臧恒佳
责编:潘颖