糖尿病:包装问题
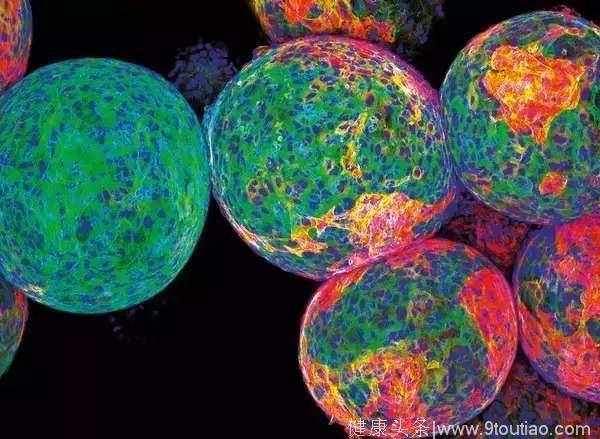
糖聚合物球体被设计用于包装工程细胞
● 当免疫系统没有阻碍的时候,细胞疗法可以治愈Ⅰ型糖尿病。
道格拉斯•梅尔顿(Douglas Melton)给了自己一段简短的庆祝时间。经过23年的努力,他终于成功地在实验室里培养出替代性胰岛细胞或细胞簇,这正是在Ⅰ型糖尿病中被摧毁的胰腺组织。梅尔顿的两个孩子就患有这种自身免疫性疾病——Ⅰ型糖尿病。梅尔顿是马萨诸塞州坎布里奇市哈佛干细胞研究所主任,他将胚胎干细胞转化成了胰岛中专有的能感受葡萄糖和分泌胰岛素并以此控制血糖的β细胞。
这一研究的影响是巨大的,它可以源源不断地提供β细胞,对于Ⅰ型糖尿病患者意味着他们将不再需要从已故的供体那里获得胰岛来移植。由于捐献器官量的不足,这种方法每年仅可以帮助几百个病人获得治疗。仍有数以百万计的Ⅰ糖尿病的成人和儿童患者面临每天不断地监控血糖水平并每天给自己注射胰岛素的困境。
在实验团队的一次聚会上,梅尔顿给团队成员每人送了一顶印有他签名的蓝色帽子,帽子上显示了从干细胞到β细胞的发展进程。梅尔顿因为在实验室成功培养出数以百万计的β细胞获得了2016年小川-山中干细胞奖。但是现在,梅尔顿又面临一个新的挑战:如何保护移植细胞免受机体的自身免疫攻击。“突然出现了很大的问题,”梅尔顿说,“这还是一个很重要的问题。”
为了预防免疫排斥——因为实验细胞是从不相关的供体而来,再加上受体胰岛直接的自身免疫,患者需要终身服用免疫抑制药物。但这些药物有严重的副作用,包括增加感染和患癌症的风险。梅尔顿想要避免使用这些药物,意味着他需要某种设备或材料,可以为实验室培养的或供体的β细胞植入时免于免疫系统的排异,同时允许营养物质如葡萄糖、胰岛素和氧气在这些细胞里进出自如。
“理想的是能够建立某种免疫隔离装置,能使人们利用细胞的益处,而无须抑制他们的免疫系统。”梅尔顿的一个合作者、麻省理工学院生物工程师丹尼尔•安德森(Daniel Anderson)解释说。
这个问题已经困扰研究者、企业家和大型制药公司40多年。多亏了新技术从头开始制造出β细胞,现在能够开发出一致性高和可靠的细胞来源。这意味着可以有条不紊地开展不同细胞包装系统的比较研究,明显优于之前的传统方法。正如梅尔顿所说,一致性高和稳定可靠的细胞来源有助于细胞保护技术和设备的研究。
一些公司开始行动。位于加利福尼亚州圣地亚哥的再生医学巨头Viacyte公司将成千上万的β细胞装载到和人的手掌一样大的大型包装设备中;处在起步阶段的位于马萨诸塞州坎布里奇的Sigilon公司,将单独成束的β细胞打包放进比一粒芥菜种还小的壳里。这两种策略前景可期。朱莉亚•格林斯坦(Julia Greenstein)说,“我们正处在一个转折点上,我们已经看到了比以前更多的解决这个问题的方法。”她是纽约一个非营利机构青少年糖尿病研究基金会(JDRF)的研发副总裁。

道格拉斯•梅尔顿(后),哈佛干细胞研究所主任,他已经找到了一种好的处理β细胞的方法
隐身模式
多年来,最受欢迎的用于移植β细胞的载体是被称为海藻酸的海藻萃取液,已在啮齿动物、狗、猴子,甚至人类试验的临床研究测试过。人体试验表明,该材料是安全的,即使在那些没有服用免疫抑制剂药物的人群中。但治疗的益处仍然模棱两可,因为在植入的数周内,海藻酸通常会开始吸引免疫细胞如巨噬细胞和中性粒细胞聚集。这导致了堵塞载体囊的纤维疤痕组织的沉积,抑制了包装内部的β细胞。
这种类型的免疫反应不同于最初的摧毁了病人β细胞的反应,但是它对这种治疗方法的前景也同样有杀伤力。安德森和他麻省理工学院的同事罗伯特•兰格(Robert Langer)在寻找可以逃避免疫的海藻酸的衍生物,研究人员在小鼠体内系统地筛选接近800个海藻酸的化学分支。他们发现一个品种——三唑-硫代吗啉海藻酸二氧化物——似乎完全被免疫系统所忽视。
这种大分子海藻酸的微球体在猕猴体内幸存了6个月。当负载上梅尔顿团队的β细胞,载体囊可以在Ⅰ型糖尿病老鼠模型体内恢复到特有的血糖水平,并且没有免疫反应的迹象。“我们第一次证明了这种材料植入人体无纤维变性。”麻省理工学院从事该项生物材料研究的博士后奥米德•韦瑟(Omid Veiseh)说,“之前从没有发生过这样的事情。”
韦瑟将于2017年在德克萨斯州休斯敦莱斯大学建立自己的实验室。但在那之前,他仍在坎布里奇帮助Sigilon公司。这个研究以西班牙语单词“秘密”命名,Sigilon公司斥资3 750万美元用于将这些新海藻酸商业化。其中包括两个潜在治疗Ⅰ型糖尿病的方法。一个是微型包装细胞疗法。到2018年,Sigilon公司打算向人们展示,该技术在接受供体胰岛的人群中是可行的,并测试包裹在藻酸盐里的β细胞的生物效果。第二种方法是使用材料覆盖部分胰腺仿生系统然后再进入人体。2016年9月,美国食品药品管理局批准了第一个人造胰腺系统,该设备可以在病人血糖高时自动供给胰岛素,又能当血糖水平开始下降时自动关闭胰岛素输送,几乎不需要病人的干预。这个人造胰腺系统是总部设在都柏林的医疗设备公司美敦力开发的MiniMed 670G——该装置结合了两种设备:一个监控血糖水平,另一个注入胰岛素并且可以自动调控胰岛素输送。
“不管怎样,”Sigilon总裁兼首席执行官保罗•沃顿(Paul Wotton)说,“Ⅰ型糖尿病患者将受益于这一平台。”

Semma疗法
在微型包装领域,规模很重要。超级海藻酸仍在测试中,麻省理工学院的团队使用直径1.5毫米的载体囊,它被证实免疫原性远低于糖尿病细胞疗法领域的研究人员常规使用的0.5毫米的载体囊。但直径增加3倍意味着每个载体囊增加了近30倍的体积。控制一个人的糖尿病需要大量的含有数亿β细胞载体囊,而身体内只有很少的地方可以移植。
载体囊可能不会适用于皮下或其他可收回的位置,为了安全起见,任何植入糖尿病患者的干细胞来源疗法应该完全可收回。佛罗里达州迈阿密大学生物工程师爱丽丝•托梅(Alice Tomei)开发了她所说的“缩微技术”(shrink-wrapping technology),它使用微流体技术将薄的生物相容的涂层披覆细胞簇,产生尽可能最小的载体囊——横径只有0.2毫米。她选择的材料是聚乙二醇,可能比Sigilon公司的超级海藻酸造成更多的免疫反应,但托梅认为她的“缩微技术”可以将细胞包装得足够小,更容易植入体内。
托梅使用梅尔顿团队的β细胞评估她的技术,在马萨诸塞州坎布里奇合作启动Semma疗法。梅尔顿与生物技术投资者和企业家罗伯特•米尔曼(Robert Millman)在2015年推出Semma(米尔曼妻子起的名字来自Sam和Emma,梅尔顿两个患糖尿病孩子的名字)。尽管Semma之前已经收购了药物输送技术公司Cytosolv,有自己的封装技术,但也在寻找像托梅这样的合作伙伴与干细胞公司一起测试一系列封装系统。“任何有设备的人,我们都能与他们合作,”Semma首席执行官米尔曼说,因为即使最好的细胞,如果我们没有正确的设备还是会失败。”
Semma的另一位合作者是位于以色列罗斯艾因城Beta-O2技术公司,它十多年来一直致力于Ⅰ型糖尿病包装细胞治疗。顾名思义,Beta-O2创新了植入细胞的输送氧气方式——一个对于大型包装设备尤为严重的问题,比起载体囊技术来说,血供携氧问题对于急需能量的β细胞是一个更大的障碍。
公司最初的产品原型是将一个冰球大小的腔室植入皮下,需要每天注射氧气。Beta-O2公司在德国和瑞典通过加载供体胰岛并将这种设备移植在5个病人中来测试它。结果是令人鼓舞的:细胞能健康存活好几个月。Beta-O2公司正在研究其第二代设备,根据公司首席执行官尤瓦尔•阿佛尼(Yuval Avni)的说法,能够使得更多的细胞一周只需要注射一次氧气。但该公司需要一个更可靠的细胞来源,阿佛尼对梅尔顿的细胞寄予厚望。

应用到临床
梅尔顿最初制造β细胞的方法很烦琐。需要35天内仔细更换5种不同的培养基,这5种培养基分别混合11种不同的成分,包括糖类和蛋白质。梅尔顿实验室的前博士后菲利希亚•帕柳卡(Felicia Pagliuca)现在领导着Semma细胞生物学研究和发展,她和她的团队已经大大简化了方案。目的是希望尽早进入临床试验,他们的一个包装设备已经开发出来。
这个制造β细胞的计划是从那些需要胰岛素的人中创造诱导多能干细胞,他们的身体不攻击自己的细胞。因为这样就没有组织不匹配或造成自身免疫反应,所以这些细胞不使用任何免疫抑制药物或屏障的技术就可以植入到患者体内。
Semma公司致力于三个患者群体:一个叫作消瘦型糖尿病的Ⅱ型糖尿病患者,病人体内的β细胞停止工作了;另一个是因慢性炎症等问题行外科手术切除胰腺病史的;还有一个是胰岛素依赖型的囊性纤维化患者。公司希望3到4年内在其中一个群体中测试他们的细胞数量,晚些时候再用包装设备对Ⅰ型糖尿病人进行试验。
但这意味着Semma可能与对手ViaCyte进行竞争。早些时候,ViaCyte公司收购了它主要竞争对手之一强生公司的BetaLogics部门,同时也宣布了第一个在Ⅰ型糖尿病患者中使用干细胞来源的β细胞包装产品的人类试验的初步数据。
ViaCyte公司的PEC-EnCap设备是膏药大小的半透袋,其中包含成千上万的来自于胚胎干细胞的胰腺前体细胞。公司使用前体细胞,而不是完全成熟的β细胞,因为这些细胞当包装还没有完全整合入血液系统中时更能耐受低氧条件下的植入。过去两年,ViaCyte公司在大约20名没有免疫抑制的患者皮下植入该设备。在许多受者中,胰腺前体细胞已成长为生产胰岛素的β细胞——尽管这些细胞在几个月后由于设备外纤维化的免疫反应而凋亡。
“这是一个可行性的证明,这可以实现,但是我们仍然有很多工作要做,”ViaCyte公司的首席执行官保罗•莱科宁(Paul Laikind)说,“现在的目标是推迟细胞灌输的异物反应时间。”ViaCyte公司希望通过修改包装设备或其他方面的治疗方案,在进入使用完整治疗剂量的产品试验阶段之前来实现这个目标。
到那时,或许梅尔顿的β细胞也可以在Ⅰ型糖尿病患者中测试。梅尔顿相信,有了正确的输送系统,这些细胞可以治愈他孩子的病。“它对我是有意义的,”梅尔顿说,“如果能制造出一个人身体里已经消失的细胞,我们应该能够找到一个方法把这样的细胞送回人体。”
马晋平/编译 世界科学(World-Science)