颠覆常识!化疗反而增加了乳腺癌转移风险
在人类与癌症抗击的历程中,化疗是被我们使用了很久的一种武器。通过化学药物来抑制细胞分裂,患者的病情往往能得到立竿见影的控制。因此,在乳腺癌的治疗中,医生们往往会先对患者进行化疗,抑制患者肿瘤的生长,然后再进行手术,切除病灶。在所有人看来,这是最保险的治疗手段。
然而,近日发表在《科学》子刊《Science Translational Medicine》上的一项研究颠覆了许多人的常识。这项研究发现,在乳腺癌手术前使用化疗,可能反而增加了癌症的转移风险!
这项研究得到了《科学》官网的大力报道(图片来源:《科学》)
这项研究来源于一项敏锐的发现。来自知名科研机构爱因斯坦医学院(Albert Einstein College of Medicine)的研究人员意识到,在往化疗的药物中添加紫杉醇后,患者的完全缓解率有着显著上升,但却不能延长患者的总体生存率。另一些数据则说明,类似于紫杉醇的化疗药物竟然与血管生成、肿瘤生长有关。这些怪异,甚至有些自相矛盾的发现让研究人员们百思不得其解,也促使他们开展了这项研究。
首先,他们在小鼠模型中确认了紫杉醇的疗效。在多种不同类型的乳腺癌小鼠模型中,研究人员分析了大量的生理指标,并确认紫杉醇的确能起到控制肿瘤生长的作用。在所有的小鼠模型里,肿瘤的生长均得到了延缓。
然而研究人员却发现,在紫杉醇的治疗后,小鼠体内的“肿瘤转移微环境”有所增多。“肿瘤转移微环境”是一种在乳腺癌转移过程中起到关键作用的生理特征,这种微环境由三类交织在一起的不同细胞组成:一类是表达MENA蛋白的肿瘤细胞,一类是血管周围的巨噬细胞,另一类则是内皮细胞。这三种细胞的密度,和乳腺癌转移的风险挂钩。
化疗药物紫杉醇竟然会增加肿瘤转移微环境,这出乎了所有人的意料。
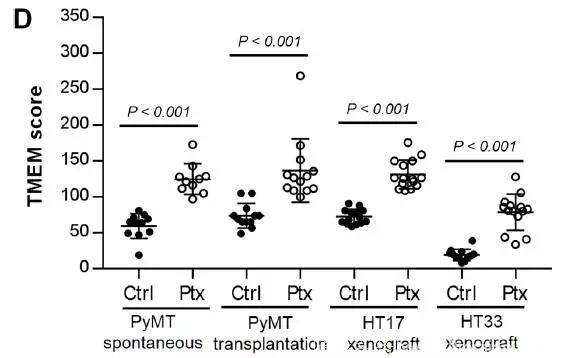
在所有的小鼠模型中,紫杉醇化疗都显著增加了“肿瘤转移微环境”评分(图片来源:《Science Translational Medicine》)
为了解释这一奇怪的现象,研究人员又进一步分析微环境中,哪些细胞出现了异常增加。实验表明,紫杉醇影响了肿瘤间巨噬细胞的密度。后续的研究则表明,新增的巨噬细胞中,带有TIE2/VEGF的巨噬细胞比例尤其多。这些结果暗示,紫杉醇化疗可能促进了血管生成,从而在抑制肿瘤生长的同时,不小心为日后肿瘤的卷土重来铺平了道路。
为了进一步评估紫杉醇化疗对小鼠血管生成的影响,研究人员通过荧光标记的方法,分析在固定时间内,血管由于异常生长而出现破裂的次数。统计发现,在接受紫杉醇治疗的9个小鼠样本中,有4个出现了血管破裂,占总体比例的45%。而在对照组的10个小鼠样本中,这一数字是0!
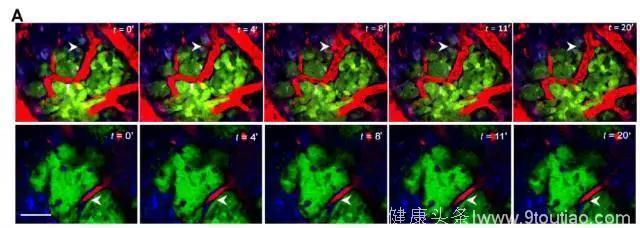
紫杉醇化疗后的小鼠样本更容易出现血管破裂(上图白色箭头)。红色为血管,绿色为肿瘤细胞,蓝色为巨噬细胞(图片来源:《Science Translational Medicine》)
在晚期肿瘤中,血管的破裂是一个很常见的现象,这也利于癌细胞的传播。然而,研究中所使用的均为早期乳腺癌小鼠模型。出现如此高频率的血管破裂,就显得很异常了。研究人员认为,紫杉醇化疗正是由于增加了肿瘤转移微环境中的血管通透性,才使得癌细胞传播和转移的风险出现上升。
糟糕的是,这一现象似乎并不限于紫杉醇化疗。研究人员进一步探索了其他化疗药物对肿瘤微环境的影响,并发现多柔比星/环磷酰胺等几款常用的化疗药物,也有类似紫杉醇的效果。这样看来,化疗增加肿瘤转移的风险,具有一定的普遍性。
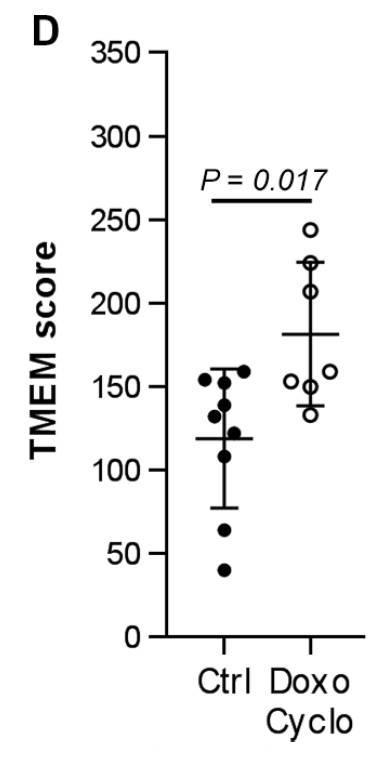
多柔比星/环磷酰胺也会增加“肿瘤转移微环境”评分(图片来源:《Science Translational Medicine》)
读到这里,一些读者可能会指出,这都是小鼠实验,不一定在人类患者中有普适性。研究人员也同样想到了这一点。因此,他们进一步分析了人类患者中的数据。在一项研究中,他们评估了20名ER+/HER2-的乳腺癌患者的“肿瘤转移微环境”密度。这些患者先是每周接受紫杉醇化疗,连续治疗12周,然后再接受四轮多柔比星/环磷酰胺的治疗。化疗后,她们的病灶的确有所缩小,但研究人员发现,大部分患者的“肿瘤转移微环境”评分有着显著上升,有5名患者的评分上升了5倍之多!这些数据证实了化疗会增加人类患者乳腺癌转移的风险,为乳腺癌患者带来预料外的长期副作用。
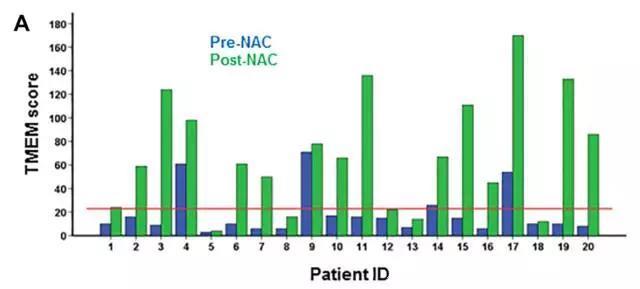
在20名乳腺癌患者在化疗(绿色)后,大部分患者的“肿瘤转移微环境”评分有所上升(图片来源:《Science Translational Medicine》)
只有了解疾病本身,我们才能更好地治疗疾病。先前我们提到,肿瘤微环境中的巨噬细胞,TIE2/VEGF的表达会增多。如果抑制TIE2,是否就能减少“肿瘤转移微环境”的增多呢?为了回答这个问题,研究人员寻找到了一款已经得到美国FDA批准的TIE2抑制剂rebastinib,并将它应用于小鼠模型。结果如同他们所预料,表达TIE2/VEGF的巨噬细胞果然变少了,并使血管破裂等异常现象完全消失。这些数据表明,rebastinib与紫杉醇等化疗药物联用,有望在起到控制病情的同时,不增加肿瘤转移的风险。
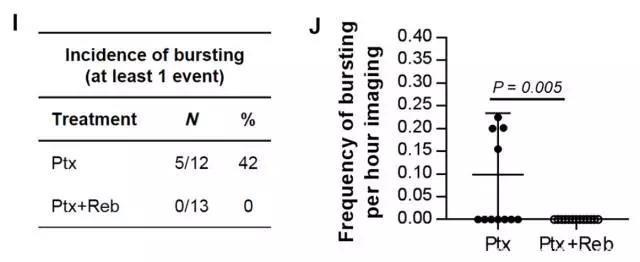
紫杉醇与rebastinib联用后,显著降低了血管破裂几率(图片来源:《Science Translational Medicine》)
当然,研究人员也表示,他们还需要做更多的实验,来验证这一思路在人体中的可行性。此外,他们也建议,医生们可以考虑改变目前的乳腺癌治疗方法。比如他们可以先进行手术,再对患者进行化疗。
点击“阅读原文”,即可访问原始论文页面。
参考资料:
[1] Neoadjuvant chemotherapy induces breast cancer metastasis through a TMEM-mediated mechanism
[2] Test Ties Chemotherapy to Possible Breast Cancer Spread
[3] Neoadjuvant chemotherapy induces breast cancer metastasis through a TMEM-mediated mechanism
本文来源生物探索,如有侵权请联系我们删除。